Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Понятие о буферностиБиблиотека / Определение содержания аскорбиновой кислоты в яблоках различных сортов / Библиотека / Определение содержания аскорбиновой кислоты в яблоках различных сортов / Понятие о буферности Понятие о буферности
Измерение рН растворов сильных кислот в присутствии слабых концентраций солей этих кислот показывает, что концентрация водородных ионов изменяется мало (при разбавлении растворов). Совсем иначе обстоит дело для растворов слабых кислот и их солей. Величина рН слабых кислот в значительной степени зависит от присутствия в растворе щелочных солей этих кислот. Прибавление щелочных солей в растворы слабых кислот может изменить рН на несколько единиц от рН первоначального раствора. Величина концентрации протонов, соответствующая сильнокислой реакции, может быть достигнута прибавление кислот, более сильная щелочная область устанавливается прибавлением более сильных оснований и их солей. Все эти смеси называют буферными растворами, или смесями.
Примерное вычисление рН смесей солей и кислот может быть произведено по простейшей формуле
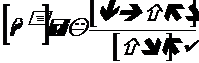 , где
, где
К – константа диссоциации.
Необходимая концентрация водородных ионов может быть произведена по нашему желанию, что имеет большое практическое значение и чем постоянно приходится пользоваться.
Смеси кислот с их солями (буферные смеси) обладают важным свойством, состоящимх в устойчивом сохранении [H×] при сильных разведениях. Это свойство представляет большую практическую ценность. Однако буферное действие этих разбавленных растворов понижается. Всякий буферный раствор может нейтрализовать только известное предельное количество кислоты или щелочи т.е. обладает определенной буферной емкостью. Емкость буфера тем больше, чем больше молей буферного вещества будет содержаться в данном растворе. Вытяжки из некоторых растительных объектов обладают значительной буферностью.
Смотрите также
Монослой на поверхности
воды
Наряду с полностью гидрофильными и
гидрофобными молекулами существуют еще и молекулы вроде русалок – одна их часть
гидрофильная, а другая гидрофобная. [7]Такие молекулы получили название амфифильных ...
Классификация взрывов по плотности вещества, по типам химических реакций
Горение - с детства и
навсегда поражающий наше воображение феномен природы - несомненно один из важнейших
для природы и человеческой практики физико-химических процессов. Греческий миф о
Пр ...
Автоматизированная система для исследования кинетики быстрых химических реакций
...


