Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
химические
свойстваБиблиотека / Одноосновные насыщенные карбоновые кислоты / Библиотека / Одноосновные насыщенные карбоновые кислоты / химические
свойства химические
свойства
Карбоновые кислоты, как и спирты, способны образовывать водородные связи. Если акцептором является достаточно сильное основание, образование водородной связи предшествует полному переносу протона к основанию. В этом случае донор водородной связи считают «кислотой». Будет ли данное соединение «донором водородной связи» или «кислотой», зависит от природы «акцептора водородной связи» или «основания». Чем сильнее основание, тем больше вероятность того, что данное соединение будет вести себя по отношению к нему как кислота:
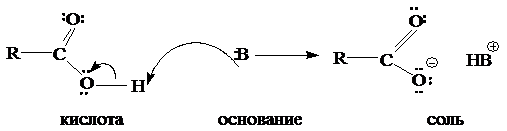
Межмолекулярные водородные связи, возникающие между молекулами карбоновых кислот, настолько прочны, что даже в газообразном состоянии значительная часть молекул существует в виде димеров:
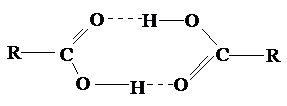
С ростом углеводородной цепи способность кислот к образованию водородных связей уменьшается.
Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты, из-за стабилизации карбоксилат-аниона, вызванной делокализацией p-электронов. Другими словами, карбоксилат-ион стабилизирован вследствие резонанса:
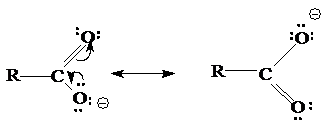
Степень делокализации изменяется в ряду RCOO- >>RCOOH >> ROH, RO-.
RO- + +BH
Энергия
RO-H + B
RO-H + :B « RO- + +BH
координата реакции
b
1
Энергия
2
a
RCOOH + :B « RCOO- + +BH
координата реакции
Энергия а - стабилизация, вызванная делокализацией в RCOOH; b - стабилизация, обусловленная делокализацией в RCO-; 1 - гипотетическая кривая, делокализация отсутствует; 2 - истинная кривая, имеется делокализация.
Кислотность выражают количественно через константу кислотности (называемую также константой диссоциации) Ка или через рКа:
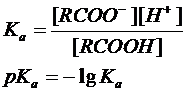
Константы кислотности большинства карбоновых кислот составляют около 10-5 (например, для уксусной кислоты 1,8×10-5), что свидетельствует о довольно высокой концентрации неионизированной формы кислоты. Поэтому большая часть карбоновых кислот относится к слабым кислотам. Кислотность больше для тех кислот, в молекуле которых имеется заместитель, стабилизирующий карбоксилат-ион. К таким заместителям относятся галогены и прочие электроотрицательные группы. Влияние заместителей на кислотность показано в Таблице.
|
Кислота |
рКа |
|
CH3COOH |
4,8 |
|
ClCH2COOH |
2,9 |
|
Cl2CHCOOH |
1,3 |
|
Cl3CCOOH |
0,7 |
|
FCH2COOH |
2,6 |
|
CH3CH2CH2COOH |
4,8 |
|
F3CCOOH |
0,2 |
Смотрите также
Бутадиен-стирольные каучуки, получаемые в растворе и эмульсии
Бутадиен-стирольные каучуки (дивинил-стирольные каучуки, БСК,
СКС, СКМС, ДССК, америпол, интол, карифлекс, крилен, нипол, плайофлекс, SBR,
синпол, солпрен, стереон, тьюфден, филпрен, юниден) ...
Сульфиды
Сульфиды — природные
сернистые соединения металлов и некоторых неметаллов. В химическом отношении
рассматриваются как соли сероводородной кислоты H2S. Ряд элементов
образует с серой полисульфиды, я ...
Качественный анализ неизвестного вещества
Аналитическая химия имеет огромное практическое значение в жизни
современного общества, поскольку создает средства для химического анализа и
обеспечивает его осуществление.
Химический ан ...


