Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Индуктивный эффект и эффект поляОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Индуктивный эффект и эффект поля Индуктивный эффект и эффект поляСтраница 2
Представление об индуктивном эффекте объясняет, почему происходит изменение констант скоростей и равновесий при введении в молекулу какого-либо полярного заместителя. Например, индуктивный эффект хлора в 2-хлорэтиламине
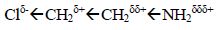
делает атом азота более положительным, чем он был бы при отсутствии хлор-заместителя (в этиламине). Следовательно, атом азота будет сильнее притягивать имеющуюся у него электронную пару и будет менее склонен разделять ее с протоном при образовании аммонийной соли
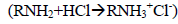
, чем этиламин. Поэтому введение хлора в качестве заместителя в молекулу этиламина должно уменьшить основность амина, что и наблюдается экспериментально. Однако этот наблюдаемый эффект хлора качественно можно объяснить также и эффектом поля.Эффект поля обусловлен взаимодействием диполя с положительным зарядом на азоте и передается через среду, разделяющую диполь от заряда, по кратчайшему расстоянию. Эффект поля зависит от диэлектрической проницаемости среды. Поскольку положительный заряд диполя Cl-C ближе к атому азота аминогруппы, диполь дестабилизирует положительный заряд на азоте.
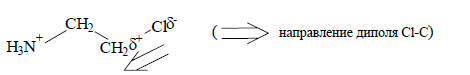
Таким образом, эффект поля тоже должен уменьшать основность амина. В большинстве случаев индуктивный эффект и эффект поля действуют в одном направлении. Поэтому отделить один эффект от другого очень трудно и их часто рассматривают совместно. Комбинацию индуктивного эффекта и эффекта поля называют полярным эффектом. Однако используют и простой термин «индуктивный эффект», подразумевая, что в это понятие включается и индуктивный эффект Льюиса, и эффект поля. В данной книге оба термина применяются на равных правах.Количественной мерой полярных (индуктивных) эффектов являются безразмерные константы заместителя σ, входящие в уравнение Гаммета-Тафта (см. гл. 3). Качественные ряды изменения индуктивных эффектов различных групп приведены в табл. 2.5. По классификации Ингольда электроноакцепторные группы обладают отрицательным индуктивным эффектом (-I), а электронодорные - положительным индуктивным эффектом (+I).Таблица 2.5.Индуктивные эффекты групп
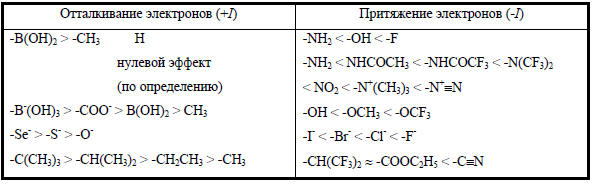
При анализе табл. 2.5 можно сделать ряд полезных заключений, которые помогают оценить относительную силу индуктивного эффекта различных групп.Основные выводы следующие.1. Групп, притягивающий σ-электроны (σ-акцепторных), т.е. обладающих отрицательным индуктивным эффектом, гораздо больше, чем групп, отталкивающих σ-электроны (σ-донорных), т.е. обладающих положительным индуктивным эффектом. Дело в том, что в качестве нулевой точки отсчета выбран водород («незамещенное» соединение все-таки имеет заместитель, но этот заместитель - Н), для которого эффект принят за нуль. В шкале Полинга (табл. 1.1) водород имеет сравнительно низкую электроотрицательность (2,20) и почти все атомы, менее электроотрицательные, чем водород , - это атомы металлов. Большинство же атомов, входящих в состав наиболее распространенных органических функциональных групп, - это атомы элементов (N, O, P, S), более электроотрицательных, чем водород. Поэтому по сравнению с «заместителем» Н такие группы будут обладать эффектом притяжения электронов. Если бы в качестве стандартного «заместителя сравнения» был выбран не водород, а электроотрицательный атом, например, фтор, то большинство заместителей мы должны были бы отнести к классу «σ-электроноотталкивающих», т.е. σ-донорных.2. Главную роль в величине индуктивного эффекта играет заряд на центральном атоме группы, т.е. на атоме, непосредственно связанном с углеродной цепочкой, по которой эффект передается к реакционному центру. К группам с огромным отрицательным индуктивным эффектом относятся диазо-группа (-N+≡N) и фенилгалогенониевые группы (-Cl+Ph, -Br+Ph, -I+Ph); меньшим, но все же достаточно большим индуктивным эффектом обладают триметиламмонийная группа (-N+Me3) и нитрогруппа (-N+(=O)O-) с положительным зарядом на атоме азота. Отрицательно заряженные группы (-O-, -COO-, B-(OH)3) проявляют (+I)-эффект, т.е. отталкивают электроны.3. Как для нейтральных, так и для заряженных групп главную роль играет электроотрицательность центрального атома. С ее ростом в ряду групп одинакового зарядного типа (+I)-эффект уменьшается (например, -Se- > -S- > -O-), a (-I)-эффект увеличивается (например, -NH2 < -OH < F). Однако из этого правила имеется и ряд исключений. Так, металлоорганические группы типа -HgPh или -SnPh3 , содержащие в качестве центрального атома тяжелые металлы, обладают хотя и небольшим, но акцепторным эффектом, несмотря на то, что электроотрицательность металлов (Hg, Sn) меньше электроотрицательности водорода.Индуктивный эффект алкильных групп (положительный) возрастает при переходе от метильной группы к первичным и далее к вторичным и третичным группам, например (+I)-эффект: СН3 < CH2CH3 < CH(CH3)2 < C(CH3)3.Хотя разница в величине индуктивного эффекта для различных алкильных групп невелика, этого вполне достаточно, чтобы дипольные моменты алкилгалогенидов не подчинялись правилу векторных сумм, о чем говорилось в начале этого раздела.
Смотрите также
Прогнозирование критической температуры. Алканы и алкены
...
Химические элементы в организме человека
Многие учёные считают, что в живом организме не только
присутствуют все химические элементы, но каждый из них выполняет определённую
биологическую функцию. Достоверно установлена роль около ...


