Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Индуктивный эффект и эффект поляОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Индуктивный эффект и эффект поля Индуктивный эффект и эффект поляСтраница 1
Дипольный момент молекулы можно рассматривать на основании двух принципиально различных подходов. Первый подход состоит в том, что общий дипольный момент представляют как векторную сумму диполей отдельных связей. Второй основан на рассмотрении молекулы как системы нескольких фрагментов, поляризующихся в поле, создаваемом диполем полярной группы.Если рассматривать дипольный момент как векторную сумму, то очень легко объяснить, почему такие молекулы, как метан, четыреххлористый углерод, пара-дихлорбензол, не имеют дипольного момента, а хлорбензол, мета- и орто-дихлорбензолы обладают дипольным моментом, причем μорто>μмета.
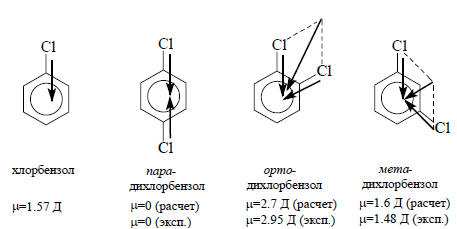
Приведенные данные для орто- и мета-дихлорбензолов показывают, что рассчитанные по векторной сумме значения дипольных моментов могут существенно отличаться от экспериментально определенных. В принципе, векторную сумму можно привести в точное соответствие с экспериментом, если учесть, что моменты связей С-Сl не постоянны и при переходе от одной молекулы со связью С-Сl к другой меняются. Однако, такой подход был бы слишком тривиальным и не имел бы предсказательной ценности, поэтому дипольный момент данной связи рассматривают как постоянный параметр. В таком случае, считая дипольный момент связи sp3-C-H постоянным, можно утверждать, что для любого насыщенного углеводорода (алкана), имеющего правильное строение с тетраэдрическими углами между связями (109,5о), дипольный момент равен нулю. Это согласуется с экспериментом: до сих пор ни у одного алкана не найдено дипольного момента, несмотря даже на то, что многие из них не имеют правильного тетраэдрического строения (из-за пространственного отталкивания объемистых алкильных групп). Таким образом, мы видим, что в некоторых случаях векторная сумма правильно передает наблюдаемый дипольный момент, а в других наблюдаются отклонения. Тогда говорят о наличии «эффекта», связанного с внутримолекулярным взаимодействием полярных групп и стараются дать этому эффекту приемлемую физическую интерпретацию.Если бы моменты связей были постоянными и все углы между связями были равны 109,5о, то все алкилхлориды AlkCl имели бы одинаковый дипольный момент. Однако экспериментальные данные, полученные в газовой фазе, этому не соответствуют. Метилхлорид CH3Cl имеет дипольный момент 3,86 Д, этилхлорид CH3CH2Cl - 2,00 Д, н-пропилхлорид CH3CH2CH2Cl - 2,04 Д, изопропилхлорид (СН3)2СHCl - 2,15 Д, н-бутилхлорид CH3CH2CH2CH2Cl - 2,11 Д, трет-бутилхлорид (СН3)3СCl - 2,13 Д. Таким образом, видна тенденция к увеличению дипольного момента с увеличением размеров алкильной группы. Объяснение этого эффекта было дано Н.Льюисом в 1923 г.Льюис, развивая идею о том, что в молекулах существуют особые устойчивые электронные образования - дублеты и октеты, предложил теорию индуцированного смещения электронных пар σ-связи от одного атома к другому. Главное в этой теории заключается в предположении, что электроны смещаются не поодиночке, а парами. Вследствие большого заряда ядра атома хлора электронная пара σ-связи C-Cl «проводит больше времени» около атома хлора, чем около соседнего атома углерода. Это и есть причина того, что в алкилхлоридах атом хлора несет частичный отрицательный заряд, а атом углерода - частичный положительный заряд. Из-за наличия этого положительного заряда атом углерода, связанный с хлором, притягивает электронные пары сильнее атома углерода, не связанного с электроотрицательным заместителем. Таким образом, атом хлора вызывает последовательное смещение электронных пар σ-связей по всей молекуле.
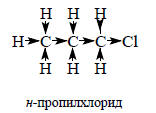
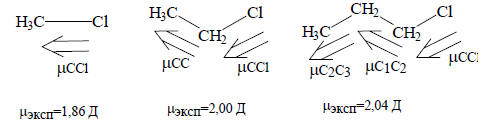
Стрелки показывают смещение электронных пар относительно «средних» положений, которые эти атомы занимали бы в отсутствие атома хлора (в пропане). Атом хлора индуцирует частичный положительный заряд (положительный по отношению к заряду, который был бы в отсутствие хлора, т.е. в пропане) на связанном с ним атоме углерода. Этот заряд индуцирует меньший по величине положительный заряд на следующем атоме углерода, который индуцирует еще меньший положительный заряд на следующем атоме и т.д. Такая способность заместителя воздействовать на σ-электронные пары вдоль цепочки атомов в теории электронных смещений называется индуктивным эффектом.Таким путем можно объяснить, почему с удлинением углеродной цепочки дипольный момент хлоралканов возрастает. Под влиянием диполя связи C-Cl бывшие неполярными в незамещенных алканах связи С-С (и С-Н) становятся полярными и диполи связей С-С складываются с диполем связи C-Cl. Например:
Смотрите также
Олигосахариды и полисахариды
...
Компоненты, обладающие свойствами понижать горючесть полимерных материалов
Ежегодно пожары
наносят экономике страны ущерб в сотни миллионов рублей. При сгорании
полимерных материалов выделяется большое количество токсичных газов, пагубно
действующих на человека и ...
Исследование комплексообразования ПКЭАК с ионами двухвалентных металлов
Актуальность темы
Известно, что
число полиамфолитов и полимерных бетаинов весьма ограничено. Линейные и
слабосшитые полимерные бетаины, содержащие кислотные и основные функциональные
гру ...


