Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Многоструктурное описание электронного строения молекулОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Многоструктурное описание электронного строения молекул Многоструктурное описание электронного строения молекулСтраница 2
Рассмотрим применение метода валентных связей более подробно на примере молекулы бензола, начав с формул Кекуле VI и VII.
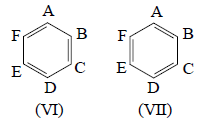
Если атомы углерода пометить буквами A, B, ., F, а π-электроны - цифрами 1, 2, ., 6, то одну из π-связей можно записать как А(1)В(2)+А(2)В(1), поскольку формально она подобна отдельной молекуле этилена (рассматриваются атомы А и В, связанные 2рπ-электронами). Вторая двойная связь - это C(3)D(4)+C(4)D(3), а третья - E(5)F(6)+E(6)F(5). Общая волновая функция для кекулевской структуры VI имеет вид
![C(3)D(4)+C(4)D(3)][ E(5)F(6)+E(6)F(5)].](images/books/232/rozdil86.gif) = [А(1)В(2)+А(2)В(1)][ C(3)D(4)+C(4)D(3)][ E(5)F(6)+E(6)F(5)].
= [А(1)В(2)+А(2)В(1)][ C(3)D(4)+C(4)D(3)][ E(5)F(6)+E(6)F(5)].
(Согласно теории, волновые функции валентных связей перемножаются).
Структура Кекуле, представленная такой функцией, накладывает ограничения на распределение рπ-электронов: она не предусматривает накопления рπ-электронной плотности между не связанными π-связью атомами (например, между В и С). Поэтому волновую функцию «улучшают», суммируя ее с волновой функцией кекулевской структуры VII:
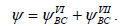
Тогда получается более реалистичное описание молекулы бензола, поскольку для структуры VII волновая функция содержит члены В(1)С(2)+В(2)С(1) и т.д., которые в сочетании с членами волной функции 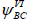 дают право говорить о распределении рπ-электронов по всему кольцу. Комбинация
дают право говорить о распределении рπ-электронов по всему кольцу. Комбинация 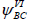 и
и 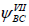 приводит к уменьшению рассчитанной энергии молекулы.
приводит к уменьшению рассчитанной энергии молекулы.
Помимо кекулевских структур в резонанс включают также структуры Дьюара VIII-X. Расчет показывает, что наилучшим образом энергия молекулы бензола согласуется с реальным значением, если положить, что вклад каждой структуры Дьюара составляет 6%, а каждой структуры Кекуле - 40%.
Однако дело не ограничивается резонансом лишь ковалентных структур Кекуле и Дьюара. Нужно учитывать также и вклад ионных структур типа XI и XII, которых так много (особенно для молекул более сложных чем бензол), что их трудно даже просто написать, не пропустив ни одной.
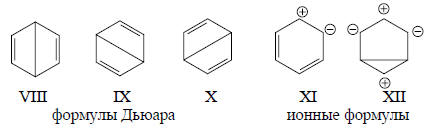
В приведенной схеме расчета используются пять ковалентных схем спаривания орбиталей: две структуры Кекуле и три структуры Дьюара. Это является достаточным базисом, так как для бензола число валентных р-АО равно шести (N=6, и следовательно, число независимых схем спаривания n=6!/[3! 4!]=5). Однако есть и другой способ расчета молекулы бензола, в котором используется лишь одна структура Кекуле и четыре структуры с «пересекающимися связями».
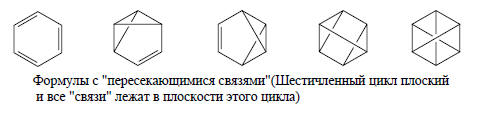
Заранее не ясно, какой из наборов структур приведет к разумным с химической точки зрения результатам. Для молекулы бензола химически предпочтителен набор из структур Кекуле и трех структур Дьюара (если не учитывать ионные структуры).
Однако при изображении бензола формулой
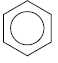
места для теории резонанса в ароматическом ряду уже нет.
Таким образом, под термином «теория резонанса» в настоящее время не подразумевается ничего более, кроме определенного способа написания структурных формул.
Резонансные структуры не вытекают из квантовой механики, а в значительной степени выбираются или интуитивно, или на основании имеющегося опыта. Например, в кетонах длина связи С=О равна 1.22 Å, а в СО2 - всего 1.15 Å, т.е. ближе к длине тройной связи С≡О (по расчету 1.10 Å). В теории резонанса это объясняется недостаточной точностью классической формулы О=С=О, и вводятся ионные структуры с тройной связью (ионноковалентный резонанс):
Смотрите также
Синтез и исследование комплексов рения (IV) с некоторыми аминокислотами
Предложены методы
синтеза комплексных соединений рения (IV) c некоторыми аминокислотами состава [К(LH)][ReХ6], (LH)2[ReХ6] и [ReL2Х4]H2O (L’–глицин-NH2-CH2-COOH; L-лейцин-((CH3 )2-CH-CH2-CH(N ...
Термический анализ
Метод исследования
физико-химических и химических превращений, происходящих в минералах и горных
породах в условиях заданного изменения температуры. Термический анализ
позволяет идентифицировать от ...


