Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Многоструктурное описание электронного строения молекулОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Многоструктурное описание электронного строения молекул Многоструктурное описание электронного строения молекулСтраница 1
Электронное строение молекул в ряде случаев не удается удовлетворительно передать с помощью обычных классических структурных формул. Например, классические формулы молекулы H-F или Na-Cl явно недостаточны для понимания свойств этих соединений. Чтобы скомпенсировать этот недостаток графических формул, их разными способами модифицируют. Например, валентный штрих заменяют на стрелку, показывающую направление смещения электронной пары, с указанием частичных зарядов, возникающих на атомах:
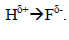
Приведенная формула полярной молекулы HF является примером одноструктурного графического изображения строения молекул, для которых классический валентный штрих не вполне достаточен. В классической формуле H-F валентный штрих отражает лишь главное отношение между атомами Н и F, а именно тот факт, что Н и F в молекуле HF связаны σ-связью, но не отражает существенного свойства этой связи - ее полярность. Вторым возможным способом отображения полярных свойств молекулы HF может быть многоструктурное описание этой молекулы с помощью двух предельных структур - ковалентной и ионной:
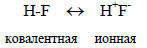
Обоюдоострая стрелка между крайними структурами означает не равновесие между ковалентной структурой и ионной парой (хотя HF действительно легко ионизируется в растворах), а только тот факт, что истинное электронное строение этой молекулы является средним между чисто ковалентным и чисто ионным. (По формуле, приведенной в примечании к табл. 1.1, можно вычислить, что ионность связи H-F составляет приблизительно 40%).
Многоструктурное изображение строения молекул впервые ввел в химию Л.Полинг, построивший теорию резонанса, которая особенно широко применялась в органической химии в 30-50-х годах. Согласно теории резонанса, в тех случаях, когда строение молекулы невозможно с достаточной степенью точности описать одной классической структурой, берут другие возможные для данной молекулы классические структуры, набор которых называется каноническими или резонансными. Суперпозиция (наложение друг на друга) таких классических структур приводит к так называемому «резонансному гибриду», который и отражает истинное электронное строение молекулы.
Главное требование, которое ни в коем случае нельзя нарушать, состоит в том, что во всех канонических структурах положение ядер в молекуле остается одним и тем же, т.е. канонические структуры не отличаются одна от другой длинами связей или углами между связями; отличие состоит лишь в распределении электронов. Но в реальных молекулах при изменении электронной конфигурации должна обязательно измениться и конфигурация ядер. Отсюда следует, что ни одна отдельная резонансная структура не отвечает реально существующему состоянию молекулы, и не может быть так, что между отдельными резонансными структурами осуществляются быстрые спонтанные переходы.
Ниже приведены некоторые примеры резонанса между каноническими классическими структурами органических молекул.
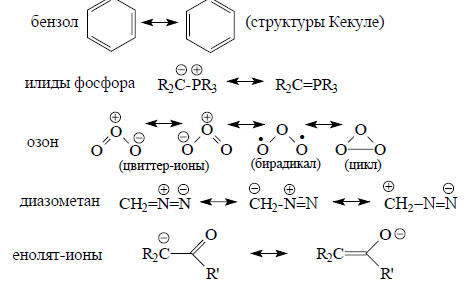
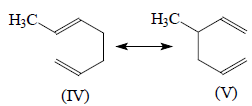
О «резонансном гибриде» как замене классической формулы имеет смысл говорить лишь в том случае, если для данной молекулы можно представить две химически одинаковые или почти одинаковые канонические структуры. Например, структуры Кекуле для бензола химически выглядят совершенно одинаково и поэтому в «резонансе» равноправны. С другой стороны, соединения IV и V нельзя считать резонансными структурами, так как это химически разные ещества, которые можно разделить по температурам кипения или хроматографическими методами.
Теория резонанса возникла в результате развития структурной теории, когда стало ясно, что электронное строение многих молекул не удается удовлетворительно описать на языке классических структурных формул. Можно заметить, что многоструктурное описание электронного строения молекул через канонические формулы удивительно похоже на представление полной волновой функции в методе валентных связей через компоненты, каждому из которых соответствует определенная схема спаривания орбиталей (см. разд. 1.11.1). На этом основании метод валентых связей нередко рассматривают как математическое обоснование теории резонанса. На самом же деле аналогия между теорией резонанса и теорией валентных связей связана только с общей методикой решения научных задач, когда приходится какое-то свойство или явление разлагать на компоненты, реальность которых вовсе не обязательна. При многоструктурном описании молекулу «разлагают» на фиктивные «резонансные структуры», а в методе валентных связей полную волновую функцию разлагают на фиктивные «компоненты», которым могут отвечать фиктивные резонансные структуры.
Смотрите также
Расчет ректификационной установки для разделения бинарной смеси ацетон-бензол
Ректификация - один из самых распространенных
технологических процессов в химической, нефтеперерабатывающей и, во многих
других отраслях промышленности.
Ректификация - это процесс раздел ...
Растворение твердых веществ
Тема контрольной работы
«Растворение твердых веществ» по дисциплине «Химическая
технология неорганических веществ».
Под термином растворение
понимают гетерогенные реакции, протекающие ме ...
Выбор катализатора амидирования и изучение в его присутствии превращения м-толуиловой кислоты в N,N-диэтил-м-толуамид
Проблема получения
репеллентов представляет большой интерес, т.к. они отличаются от других
пестицидов высокой специфичностью действия, вызывая отрицательный хемотаксис
одноклеточных организ ...


