Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Форма молекул.Органическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Форма молекул. Форма молекул.Страница 2
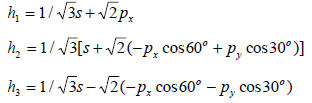
Схема образования трех sp2-гибридных орбиталей приведена на рис. 1.13, где при сложении р-орбитали рассматриваются как векторы.
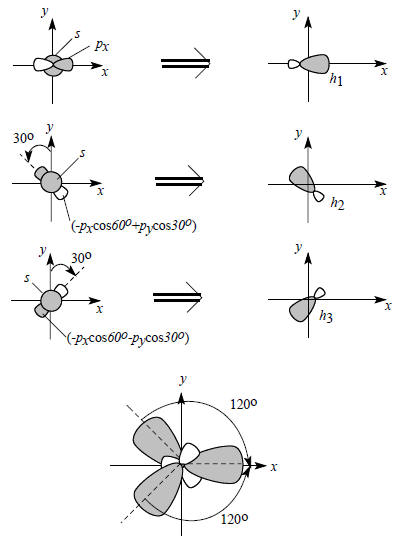
Рис. 1.13. Образование sp2-гибридных атомных орбиталей.
Таким образом, молекулы этилена является плоской и ее двойная связь имеет электронную конфигурацию σ2π2. Структура молекулы этилена приведена ниже:
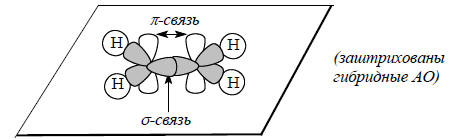
Одним из экспериментальных доказательств именно такой структуры этилена является торсионная жесткость двойной связи, т.е. отсутствие свободного вращения вокруг С=С-связи. Это обусловлено тем, что при вращении одной метиленовой группы относительно другой уменьшается перекрывание р-орбиталей, т.е. ослабляется (а при повороте на 90о исчезает совсем) π-связь. В этилене энергия π-связи составляет 65 ккал/моль - это очень высокий барьер, препятствующий внутримолекулярному вращению.
sp-Гибридизация. Молекула ацетилена (этина) НС≡СН еще более ненасыщена, чем этилен. Ее электронная структура описывается связыванием двух sp-гибридизированных атомов кглерода, каждый из которых имеет две перпендикулярные р-орбитали:
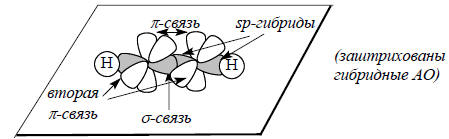
Если х-ось молекулы, то две sp-гибридные орбитали описываются следующими формулами:
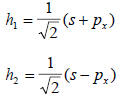
Их образование представлено в разд. 1.8.1 на примере молекулы LiH.
sp-Гибридные АО называются диагональными, они придают молекулам линейную форму.
Смотрите также
Каталитический риформинг
Бензины являются
одним из основных видов горючего для двигателей современной техники.
Автомобильные и мотоциклетные, лодочные и авиационные поршневые двигатели потребляют
бензины. В настоящ ...
Бериллий
Соединения бериллия
в виде драгоценных камней были известны еще в древности. С давних пор люди
искали и разрабатывали месторождения аквамаринов, изумрудов и бериллов. Есть
свидетельс ...


