Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Строение многоэлектронных атомов.Органическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Строение многоэлектронных атомов. Строение многоэлектронных атомов.Страница 2
Любая орбиталь может быть занята не более чем двумя электронами, и если ее занимают два электрона, направление их спинов должно быть противоположным. Запрет Паули относится как к атомным, так и к молекулярным орбиталям.
Принцип Паули запрещает, чтобы третий электрон находился на уже заполненной двумя электронами 1s-орбитали, и поэтому третий электрон занимает следующую орбиталь низшей энергии. Такой орбиталью будет одна из орбиталей с n=2. Попадет ли электрон на 2s- или на одну из трех 2р-орбиталей? Выше мы говорили, что в случае атома водорода эти орбитали были вырожденными (имели одну и ту же энергию), однако для лития и других атомов это не так. Причина состоит в том, что присутствие других электронов (на 1s-орбитали) снимает вырождение, поскольку эти электроны, как говорят, «не находятся в геометрическом центре атома». s-Электрон характеризуется ненулевой вероятностью быть найденным у ядра, тогда как р-электрон там встретить нельзя. Следовательно, 2s-электрон, несмотря на противодействие отрицательно заряженного экрана 1s-электронов, все же проникает через этот экран к ядру и находится под воздействием положительного ядерного заряда, тогда как 3р-электрон не проникает через отрицательно заряженный экран. Сумма эффектов экранирования и проникновения приводит к тому, что 2s-элеткроны по энергии лежат ниже 2р-электронов. Аналогично, для электронов с n=3 энергия возрастает в ряду 3s<3p<3d из-за эффекта проникновения через внутренние оболочки с n=1 и n=2. Другими словами, эффективный ядерный заряд для разных орбиталей неодинаков. Так, 3р-электрон натрия при учете экранирования должен находиться под воздействием меньшего эффективного ядерного заряда, чем 3s-электрон.
Итак, электронная конфигурация атома лития в основном (низшем) состоянии будет 1s22s. Чтобы построить электронную конфигурацию любого атома с номером Z, нужно представить себе атомные орбитали с последовательностью энергий 1s<2s<2p<3s<3p<3d< . и затем разместить Z электронов, начиная с орбитали низшей энергии, в соответствии с принципом Паули. Необходимо лишь помнить, что имеется только одна 1s-орбиталь, одна 2s-орбиталь и т.д., но орбиталей типа 2р, 3р и т.д. по три, орбиталей типа 3d, 4d и т.д. - по пять, а орбиталей типа 4f, 5f и т.д. - по семь. Ниже приведены электронные конфигурации основных состояний атомов первых десяти элементов.
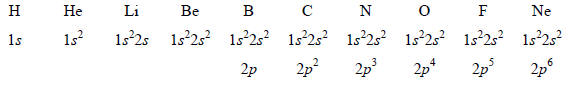
Смотрите также
Основы электрохимии.
Цель работы - овладеть
методикой измерения ЭДС и напряжения гальванических элементов; изучение
условий возникновения коррозионных микроэлементов.
Введение.
Электрохимия
изучает окислительн ...


