Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
КвантованиеОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Квантование Квантование
Любое свойство объекта, любое явление квантовано, все в мире квантовано, включая само пространство. В этом заключается основной принцип квантовой механики. Энергия объекта не может измениться на произвольную величину. Объект может обладать лишь определенными значениями энергии, и нельзя сделать так, чтобы он имел какую-то промежуточную энергию. Это, между прочим, и явилось причиной введения уравнения Шредингера, которое вместе с предложенной выше интерпретацией волновой функции успешно объясняет квантование энергии. В разделе 1.1 указывалось, что для согласия с принципом квантования некоторые из бесконечного числа решений уравнения Шредингера нужно исключить. Это можно сделать на основе вероятностной интерпретации волновой функции.
Ограничение на волновые функции можно наложить с помощью простого заключения, состоящего в том, что если ψ2dx или ψ2dτ есть вероятность найти частицу в области dx или dτ, то сумма таких вероятностей по всему пространству должна быть равна единице. Это следует из того, что частица, если она существует, определенно где-то находится, пусть даже она «размыта» по всей вселенной. Таким образом, возникает критерий полной вероятности (по-иному его называют «условие нормировки»), который налагает жесткие ограничения на волновые функции, ибо ему удовлетворяют не все решения уравнения Шредингера, а только волновые функции, нормированные к единице, когда
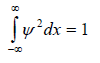
для одномерного движения или
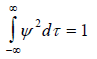
для трехмерного движения, где x - длина, а τ - объем.
Чтобы пояснить это, опять обратимся к атому водорода. В основном состоянии волновая функция пропорциональна exp(-r/a0) (см. предыдущий раздел), т.е. спадает по экспоненциальному закону при удалении от ядра. Однако интегрируя по всему пространству, можно вычислить, что условию нормировки, т.е. критерию полной вероятности, удовлетворяют не любые коэффициенты пропорциональности А в уравнении ψ=Aexp(-r/a0), а только один (называемый нормировочным множителем N), A=N=(1/πa03)1/2, который и был использован в предыдущем разделе при расчетах вероятности найти электрон на разных расстояниях от ядра. При других значениях А критерий полной вероятности не соблюдается и эти решения уравнения Шредингера неприемлемы. Если эти решения неприемлемы, то их отбрасывают, и тогда в уравнении Шредингера полная энергия Е электрона в атоме водорода не может иметь значения, соответствующие этим неприемлемым решениям. Так мы приходим к квантованию и теперь должны заявить, что возможны только некоторые значения энергии электрона в атоме водорода, поскольку другие значения соответствуют неверным свойствам распределения электрона в пространстве.
Смотрите также
Кинетика химических реакций
Одна
из особенностей химических реакций заключается в том, что они протекают во
времени. Одни реакции протекают медленно, месяцами, как, например, коррозия
железа. Другие заканчиваются очень быстро ...
Химический анализ электролита ванн хлорирования на машиностроительном заводе
...
Нестехиометрические твердые оксиды - новые vатериалы современной техники
Обычно об
открытиях в химии сообщается в специальных периодических изданиях - научных и
технических журналах. Немногие из этих сообщений попадают в ежедневные газеты,
потому что массовый чи ...


