Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Осциллографическая вольтамперометрия.Статьи и работы по химии / Исследование совместного электровосстановление гадолиния и криолита в галогенидных расплавах / Методы исследования и методика проведения эксперимента / Статьи и работы по химии / Исследование совместного электровосстановление гадолиния и криолита в галогенидных расплавах / Методы исследования и методика проведения эксперимента / Осциллографическая вольтамперометрия. Осциллографическая вольтамперометрия.Страница 1
Зависимости ток - потенциал в методе осциллографической вольтамперометрии существенно зависят от типа электродной реакции.
Рассмотрим случай обратимого процесса (2.1), скорость которого ограничена массопереносом ионов в условиях линейной полубесконечной диффузии к плоскому электроду. Аналогично методу КВА, в данном методе также необходимо различать тот случай, когда продукт электродной реакции (2.1) Red растворим в расплаве или материале электрода, и случай, когда вещество Red нерастворимо.
а) Восстановление или окисление растворимых веществ.
В данной задаче для нахождения зависимости I - j необходимо решить дифференциальное уравнение Фика при следующих граничных условиях:
t > 0, x = 0
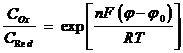
(2.4)
![]()
(2.5)
Условие (2.4) получено из уравнения Нернста, а уравнение (2.5) отражает тот факт, что массоперенос веществ Ox и Red у поверхности электродов одинаков. В осциллографической вольтамперометрии потенциал является функцией времени:
j = ji ± v t (2.6)
где v - скорость поляризации электрода (В/с). Плюс относится к анодной поляризации, а минус - к катодной.
Впервые эта задача была решена независимо Рэндлсом и Шевчиком. В общей форме зависимость I - j получена в следующем виде:
![]()
(2.7)
где l - функция, зависящая от потенциала. С учетом (2.7) ток в максимуме вольтамперной кривой (ток пика) равен:
![]()
(2.8)
Потенциал пика jp определяется следующим соотношением:
![]()
(2.9)
где плюс относится к анодному процессу, а минус - к катодному. Разность значений потенциалов пика jр и полупика jр/2 составила:
![]()
(2.10)
Уравнение (2.10) обычно используется для оценки числа электронов n, участвующих в электродной реакции (2.1).
б) Восстановление или окисление нерастворимых веществ.
В этом случае активность продукта электродной реакции (2.1) равна 1, что учитывается при формировании граничного условия (2.4), полученного на основе уравнения Нернста при t > 0, x = 0 :
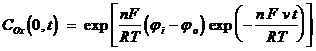
(2.11)
Решение этой задачи впервые выполнено Берзинсом и Делахеем, которые получили зависимость I - j в виде:
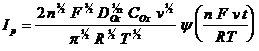
(2.12)
Уравнение для потенциала пика получено в виде:
![]()
(2.13)
где плюс относится к анодному процессу, а минус - к катодному.
Для установления механизма электродных процессов весьма ценным является также использование развертки потенциала в обратном направлении. По разности потенциалов катодного и анодного пиков, подчиняющейся для обратимых процессов соотношению:
![]()
(2.14),
а также по соотношению высот анодного и катодного пиков тока можно охарактеризовать скорость процесса переноса заряда.
Смотрите также
Программа учебной дисциплины "Биохимия"
...
Кинетика химических реакций
Одна
из особенностей химических реакций заключается в том, что они протекают во
времени. Одни реакции протекают медленно, месяцами, как, например, коррозия
железа. Другие заканчиваются очень быстро ...
Новые научные направления современной химии и их прикладное использование
Химия
- наука социальная. Её высшая цель – удовлетворять нужды каждого человека и
всего общества. Многие надежды человечества обращены к химии. Молекулярная
биология, генная инженерия и би ...


