Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Неметаллы VA‑группы. Азот. Аммиак.Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Неметаллы VA‑группы. Азот. Аммиак. Неметаллы VA‑группы. Азот. Аммиак.Страница 1
Азот – элемент 2‑го периода и VA‑группы Периодической системы, порядковый номер 7. Электронная формула атома [2He]2s22p3, характерные степени окисления 0, ‑III, +III и +V, реже +II, +IV и др.; состояние Nv считается относительно устойчивым.
Шкала степеней окисления азота:
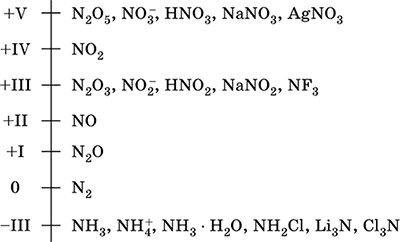
Азот обладает высокой электроотрицательностью (3,07), третий после F и О. Проявляет типичные неметаллические (кислотные) свойства. Образует различные кислородсодержащие кислоты, соли и бинарные соединения, а также катион аммония NH4+ и его соли.
В природе – семнадцатый
по химической распространенности элемент (девятый среди неметаллов). Жизненно важный элемент для всех организмов.
Азот N2.
Простое вещество. Состоит из неполярных молекул с очень устойчивой σππ‑связью N ≡ N, этим объясняется химическая инертность азота при обычных условиях. Бесцветный газ без вкуса и запаха, конденсируется в бесцветную жидкость (в отличие от O2).
Главная составная часть воздуха: 78,09 % по объему, 75,52 % по массе. Из жидкого воздуха азот выкипает раньше кислорода O2. Малорастворим в воде (15,4 мл/1 л Н2O при 20 °C), растворимость азота меньше, чем у кислорода.
При комнатной температуре N2 реагирует только с литием (во влажной атмосфере), образуя нитрид лития Li3N, нитриды других элементов синтезируют при сильном нагревании:
N2 + 3Mg = Mg3N2 (800 °C)
В электрическом разряде N2 реагирует с фтором и в очень малой степени – с кислородом:
![]()
Обратимая реакция получения аммиака протекает при 500 °C, под давлением до 350 атм и обязательно в присутствии катализатора (Fe/F2O3/FeO, в лаборатории Pt):
![]()
В соответствии с принципом Ле‑Шателье увеличение выхода аммиака должно происходить при повышении давления и понижении температуры. Однако скорость реакции при низких температурах очень мала, поэтому процесс ведут при 450–500 °C, достигая 15 %‑ного выхода аммиака. Непрореагировавшие N2 и Н2 возвращают в реактор и тем самым увеличивают степень протекания реакции.
Азот химически пассивен по отношению к кислотам и щелочам, не поддерживает горения.
Получение в промышленности– фракционная дистилляция жидкого воздуха или удаление из воздуха кислорода химическим путем, например по реакции 2С (кокс) + O2 = 2СО при нагревании. В этих случаях получают азот, содержащий также примеси благородных газов (главным образом аргон).
В лаборатории
небольшие количества химически чистого азота можно получить по реакции конмутации при умеренном нагревании:
N‑IIIH4NIIIO2(т) = N20 + 2H2O (60–70 °C)
NH4Cl(p) + KNO2(p) = N20↑ + KCl + 2H2O (100 °C)
Применяется для синтеза аммиака, азотной кислоты и других азотсодержащих продуктов, как инертная среда проведения химических и металлургических процессов и хранения огнеопасных веществ.
Аммиак NH3.
Бинарное соединение, степень окисления азота равна – III. Бесцветный газ с резким характерным запахом. Молекула имеет строение незавершенного тетраэдра [: N(H)3)] (sр3‑гибридизация). Наличие у азота в молекуле NH3 донорной пары электронов на sр3‑гибридной орбитали обусловливает характерную реакцию присоединения катиона водорода, при этом образуется катион аммония NH4+. Сжижается под избыточным давлением при комнатной температуре. В жидком состоянии ассоциирован за счет водородных связей. Термически неустойчив. Хорошо растворим в воде (более 700 л/1 л Н2O при 20 °C); доля в насыщенном растворе равна = 34 % по массе и = 99 % по объему, рН = 11,8.
Смотрите также
Распространенные элементы. строение атомов. Электронные
оболочки. Орбитали
Химический элемент– определенный
вид атомов, обозначаемый названием и символом и характеризуемый порядковым
номером и относительной атомной массой.
В табл. 1 перечислены распространенны ...
Получение и описание физико-химических свойств синтетических биодеградируемых полимеров
Биодеградируемыми
полимерами называются полимерные материалы, разрушающиеся в результате
естественных природных (микробиологических и биохимических) процессов. Полимер,
как правило, считает ...
Алифатические амины
Амины - производные аммиака, в которых атомы водорода замещены на
углеводородные радикалы. Амины классифицируют по числу атомов водорода,
замещенных на углеводородные радикалы. Различают первичные R ...


