Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ВодородCправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Cправочник по химии для подготовки к ЕГЭ / Неметаллы главных подгрупп IV–VII групп / Водород ВодородСтраница 1
Водород – первый элемент Периодической системы (1‑й период, порядковый номер 1). Не имеет полной аналогии с остальными химическими элементами и не принадлежит ни к какой группе (в таблицах условно помещается в IA– и/или в VIIA‑группу).
Атом водорода наименьший по размерам и самый легкий среди атомов всех элементов. Электронная формула атома 1s1, характерные степени окисления 0, +I и реже – I. Состояние HI считается устойчивым (соединения с H‑I – сильные восстановители).
Шкала степеней окисления водорода:
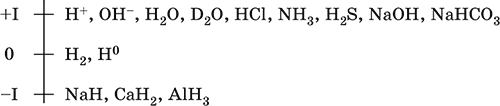
По электроотрицательности (2,10) водород занимает промежуточное положение между типичными металлами и типичными неметаллами. Проявляет амфотерные свойства – металлические и неметаллические. Входит в состав катионов (катионы оксония Н3O+ и аммония NH4+, аквакатионы металлов) и многочисленных анионов – кислыхкислотных остатков (HS‑, HCO3‑ и др.).
Природный водород содержит изотоп 1Н – протий с примесью стабильного изотопа 2H(D) – дейтерия и следами радиоактивного изотопа 3Н(Т) – трития (на Земле всего 2 кг трития). В химии символом Н в формулах веществ обозначается содержащаяся в них природная смесь изотопов с преобладанием изотопа протий, а сами вещества рассматриваются как почти изотопночистые соединения протия.
Водород – наиболее распространенный элемент в космосе (Солнце, большие планеты Юпитер и Сатурн, звезды, межзвездная среда, туманности); в состав космической материи входит 63 % Н, 36 % Не и 1 % всех остальных элементов.
В природе – третий
по химической распространенности элемент (после О и Si), основа гидросферы. Встречается в химически связанном виде (вода, живые организмы, нефть, природный уголь, минералы), содержится в верхних слоях атмосферы.
Водород Н2.
Простое вещество. Бесцветный газ без запаха и вкуса. Молекула содержит ковалентную σ‑связь Н – Н. Очень легкий, термически устойчивый до 2000 °C. Весьма мало растворим в воде. Хемосорбируется металлами Fe, Ni, Pd, Pt, где находится в атомном состоянии.
Водород Н2 может проявлять в одних условиях восстановительные свойства (чаще), в других – окислительные свойства (реже):
восстановитель Н20 – 2е‑ = 2НI
окислитель Н20 + 2е‑ = 2Н‑I
Сильный восстановитель при высоких температурах, водород реагирует с неметаллами и оксидами малоактивных металлов, выполняет роль окислителя в реакциях с типичными металлами:
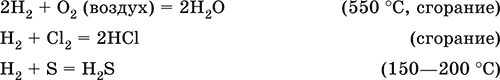

Очень высокой восстановительной способностью обладает атомарный водород Н0 (водород in statu nascendi, лат., – в момент возникновения), который получают непосредственно в зоне проводимой реакции (время жизни Н0 0,5 с); например, гранулы магния вносят в подкисленный раствор переманганата калия, протекают реакции:
а) образование атомарного водорода
Mg + 2Н+ = Mg2+ + 2Н0
б) восстановление перманганат‑иона атомарным водородом
5Н0 + 3H+ + MnO4‑ = Mn2+ + 4Н2O
Другой пример – восстановление нитробензола в анилин (реакция Зинина):
а) Fe + 2Н+ = Fe2+ + 2Н0
б) C6H5NO2 + 6Н0 = C6H5NH2 + 2Н2O
Получить атомарный водород можно также пропусканием водорода Н2 над никелевым катализатором.
Атомарный водород легко восстанавливает при комнатной температуре весьма устойчивые соединения, например KNO3 и O2:
2Н0 (Zn, разб. HCl) + KNO3 = KNO2 + H2O
2H0 (Zn, разб. HCl) + O2 = Н2O2
Аналогично протекают реакции при использовании амфигенов (Zn, Al) в щелочной среде:
а) Zn + 2OH‑ + 2H2O = [Zn(OH)4]2‑ + 2Н0
б) 8Н0 + KNO3 = NH3↑ + КОН + 2Н2O (кипячение)
Качественная реакция – сгорание собранного в пробирку водорода с «хлопком» («гремучая» смесь с воздухом при содержании Н2 4–74 % по объему).
Смотрите также
Риформинг как способ получения бензинов с улучшенными характеристиками
Бензины являются
одним из основных видов горючего для двигателей современной техники.
Автомобильные и мотоциклетные, лодочные и авиационные поршневые двигатели
потребляют бензины. В настоящ ...
Методика проведения потенциометрического титрования.
Рассмотрим процесс
потенциометрического титрования сильной кислоты раствором сильной щелочи. ...
Переработка полимерных материалов
В настоящее время
предусматривается дальнейшее улучшение обслуживания населения страны всеми
видами транспорта, в том числе и железнодорожным транспортом. Решение этой
проблемы возможно не ...


