Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Индивидуальное заданиеСтатьи и работы по химии / Гомогенное химическое равновесие / Статьи и работы по химии / Гомогенное химическое равновесие / Индивидуальное задание Индивидуальное заданиеСтраница 3
След., в равновесной смеси останется:
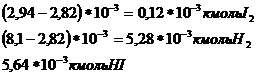
Данные вещества находятся в V=1м3, поэтому
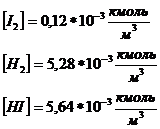
Используя полученные концентрации, определим константу равновесия:
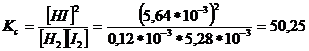
При добавлении к исх. смеси 0,100кг I2 и 0,005 кг H2 установ. равнов., но Кс не изменится. Обозначим новую равновесную конц. [HI]=x, тогда равнов. конц. [I2 ] и [H2 ] будут равны:
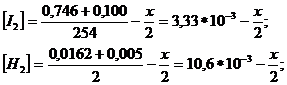
Получим уравнение:
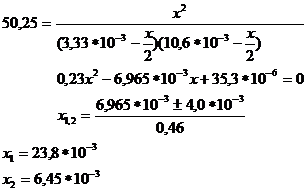
Х1 не имеет физ.смысла, т.к.конц. H2 и I2 будут иметь отрицательные значения.След., ![]() . Т.к. V=1м3, тогда
. Т.к. V=1м3, тогда
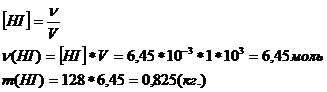
Ответ. ![]()
№4
Напишем содержание компонентов в процентах в равновесной смеси:
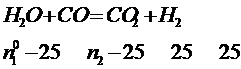
Для рассматриваемой реакции ![]()
Подставим содержание веществ (в молях) в выражение для константы равновесия:
![]()
откуда
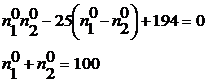
т.к. в ходе реакции число молей в системе не меняется. Исключая из этих уравнений ![]() , получим уравнение:
, получим уравнение:
![]()
Его решение даёт два действительных корня:![]() . Это означает, что в исходной смеси СО(г) по объёму может быть 36,1 или 63,9% и, соответственно, Н2О(г) 63,9 или 36,1%.
. Это означает, что в исходной смеси СО(г) по объёму может быть 36,1 или 63,9% и, соответственно, Н2О(г) 63,9 или 36,1%.
№5
Реакция образования водяного пара протекает по уравнению:
![]()
Константа равновесия равна:
![]()
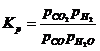
Диссоциация двуокиси углерода:
2CO+O2=2CO2
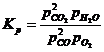
Диссоциация водяного пара:
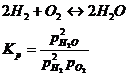
Равновесная концентрация кислорода в данных реакциях одинакова, тогда:
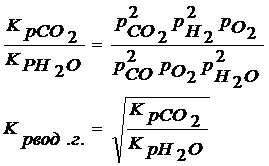
Выразим константу равновесия реакции диссоциации воды и двуокиси углерода через общее давление и степень диссоциации:
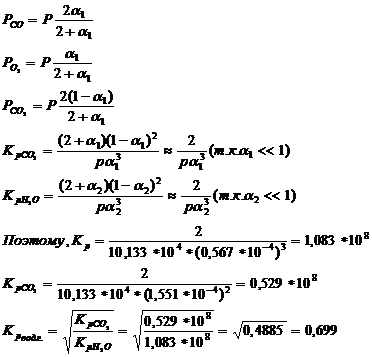
По условию начальные об. конц. воды и укиси углерода равны 50об.%, обозначим конц. образ. Н2 и СО2 в сост. равновесия x об.%, получим:![]()
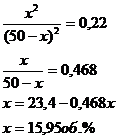
Состав водяного газа имеет вид:
![]()
Ответ. 15,95 об.%
№6
Напишем равновесные числа молей реагентов, выраженные через степень диссоциации ![]() :
:
![]()
n0 –начальное количество (число молей) водяного пара.
Константа равновесия этой реакции будет выражаться уравнением:
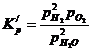
Выразим парциальные давления реагентов через общее давление Р, общее число молей ![]() и степень диссоциации
и степень диссоциации ![]() . Находим:
. Находим:
Смотрите также
Молекулы. Химическая связь. Строение веществ
Химические частицы, образованные из двух или
нескольких атомов, называются молекулами (реальными или условными
формульными единицами многоатомных веществ). Атомы в молекулах химически
связаны.
П ...
Замена углерода
Ученые немало
высказывались на тему возможности построения органических молекул с помощью
других атомов, но на практике доказать эту возможность на данный момент не
удалось.
...
Определение содержания германия в твердом электролите GeSe-GeJ2
...


