Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Индивидуальное заданиеСтатьи и работы по химии / Гомогенное химическое равновесие / Статьи и работы по химии / Гомогенное химическое равновесие / Индивидуальное задание Индивидуальное заданиеСтраница 2
Используя уравнение:
![]()
Δn- изменение числа молей газообразного конечного и начального продуктов реакции.
Кр и парц. давления выражены в н/м2.
и ур-ние ![]() определим значение
определим значение ![]() реакции:
реакции:
![]()
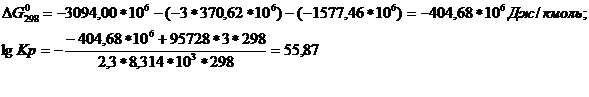
Ответ.lg Kp=55,87.
№2
В данной реакции ΔV=2-3=-1, поэтому выражение для Кх примет вид:
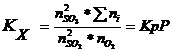
Из уравнения видно, что с увеличением давления р увеличивается константа равновесия Кх, поскольку Кр не зависит от давления. Увеличение Кх произойдёт за счёт увеличения числителя и за счёт уменьшения знаменателя. При отсутствии инертной примеси азота ![]() равна сумме молей веществ в равновесной смеси, которая при смещении равновесия изменяется незначительно, поэтому числитель увеличивается в основном за счёт увеличения
равна сумме молей веществ в равновесной смеси, которая при смещении равновесия изменяется незначительно, поэтому числитель увеличивается в основном за счёт увеличения ![]() ; одновременно должны уменьшатся
; одновременно должны уменьшатся ![]() и
и ![]() в знаменателе. Отсюда делаем вывод, что с ростом давления р в равновесной системе кол-во SO3 возрастает, равновесие сдвинется вправо, выход серного ангидрида увеличится. С увеличением кол-ва азота увеличивается сумма
в знаменателе. Отсюда делаем вывод, что с ростом давления р в равновесной системе кол-во SO3 возрастает, равновесие сдвинется вправо, выход серного ангидрида увеличится. С увеличением кол-ва азота увеличивается сумма ![]() , что влечёт за собой уменьшение
, что влечёт за собой уменьшение ![]() . Равновесие сдвинется влево, выход SO3 уменьшится.
. Равновесие сдвинется влево, выход SO3 уменьшится.
Принципа смещения равновесия Ле Шателье приводит с к следующим качественным выводам. Т.к. реакция образования SO3 из SO2 и O2 идёт с уменьшением объёма, то при увеличении давления, т.е. при сжатии реагирующей смеси, процессом ослабляющим сжатие, будет процесс, приводящий к уменьшению числа молекул в реагирующей смеси. Таким образом, при увеличении давлении реакция сдвинется слева на право и выход SO3 возрастёт.
Увеличение содержания азота при постоянном общем давлении ведёт к разбавлению реагирующей смеси, что равноценно уменьшению давления при отсутствии азота, т.е. приведёт к сдвигу равновесия справа налево, выход то равноценно уменьшению давления при отсутствии азота, ведёт к разбавлению реагирующей смесию числа молекул в реагирующей с SO3 уменьшится.
№3
Реакция протекает по уравнению:
H2+I2 ![]() 2HI
2HI
Константа равновесия этой реакции может быть выражена уравнением:
![]()
Для определения величины константы равновесия необходимо определить состав равновесной газовой смеси.
H2 и I2 реагируют с образованием HI, то в равновесной смеси исходное кол-во будет меньше, чем в исходной.
Исходная концентрация H2 и I2 :
![]()
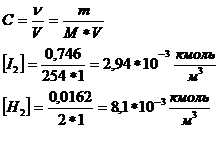
Конц. получ. HI в равновесной смеси:
![]()
Реакция протекает при постоянном давлении, тогда:
H2+I2 ![]() 2HI
2HI
1кмоль 1кмоль 2кмоль
(2,82кмоль 2,82 кмоль 5,64 кмоль)*10-3![]()
Смотрите также
Экспериментальная часть
Реагенты
и оборудование.
Уравнение
реакции имеет вид:
Реактивы:
N-фенилантраниловая кислота (С13Н11О2N, M=213 г/моль, Тпл=179-1810С) – 3г,
серная кислота (Н2SО4, M=98.08 г/моль, Тпл=-13 ...
Жизнь и научные открытия А.Л. Лавуазье и К.Л. Бертолле
Лавуазье и Бертолле – без сомнения, самые выдающиеся
ученые-химики своего времени. И по праву считаются основателями современной
химии, создателями принятой ныне химической номенклатуры.
...
Введение.
Важнейшим
свойством ряда белков является их каталитическая активность. Вещества белковой
природы, способные каталитически ускорять химические реакции, называют
ферментами. Роль ферментов в жизнедея ...


