Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Гидролиз
солей слабых кислот и сильных основанийСтатьи и работы по химии / Гидролиз солей. Особенности почвенного гидролиза / Статьи и работы по химии / Гидролиз солей. Особенности почвенного гидролиза / Гидролиз
солей слабых кислот и сильных оснований Гидролиз
солей слабых кислот и сильных основанийСтраница 1
Если соль образована слабой кислотой и сильным основанием, то реакцию гидролиза можно схематически изобразить так:
![]() М+ + А - + Н2О НА + М+ + ОН-. (4)
М+ + А - + Н2О НА + М+ + ОН-. (4)
Связывания иона гидроксония Н+ анионами слабой кислоты А - приводит нарушению равновесия реакции диссоциации воды
![]() Н2О Н+ + ОН-
Н2О Н+ + ОН-
И появлению избыточной концентрации ОН-. При этом Сн+ < Cон - и раствор имеет щелочную реакцию. Константа гидролиза реакции (4)
|
Кг= |
СНА * Сон- |
= |
СНА * Сон- |
(5) |
|
СМ+ * СА- |
СА- |
Слабая кислота НА, получающаяся при гидролизе, диссоциирует, хотя и в малой степени, на ионы:
![]()
НА Н+ + А - (6)
В противном случае гидролиз шел бы до конца - вся соль превращалась бы в НА и МОН. Выразив константу диссоциации слабой кислоты - константу равновесия реакции (6) - следующим образом:
|
К кисл. = |
СН. СА- |
|
СНА |
Можно определить через нее отношение
|
СНА |
= |
Сн+ |
(7) |
|
СА |
К кисл. |
Подставив (7) в (5), получим
|
Кг= |
Сн+ * Сон- |
= |
Кw |
(8) |
|
К кисл. |
К кисл. |
Константа гидролиза равна отношению ионного произведения воды к константе диссоциации слабой кислоты. ![]() Найдем степень гидролиза соли. Концентрация негидролизованной соли равна СМА (1 - a)
Найдем степень гидролиза соли. Концентрация негидролизованной соли равна СМА (1 - a) ![]() . Негидролизованная соль в разбавленном растворе полностью диссоциирована на ионы и поэтому ее концентрация равна концентрации аниона
. Негидролизованная соль в разбавленном растворе полностью диссоциирована на ионы и поэтому ее концентрация равна концентрации аниона
СМА - = СМА (1 - a). (9)
При гидролизе образуются эквивалентные количества молекул НА и ионов ОН-. Так как мы рассматриваем соль слабой кислоты, то НА диссоциированна в малой степени. Если пренебречь диссоциацией НА, то можно сказать что, Сон - = СНА. Молекула НА образуется из молекулы соли при гидролизе. Если гидролизовано СМА*a молей, то
Сон - = СНА= СМА*a. (10)
Подставив выражения (9) и (10) в уравнение (5), получим
|
Кг= |
С2МА*a2 |
= |
СМА*a2 |
(11) |
|
С МА* (1-a) |
1-a |
Откуда
СМА*a2 + Кг * a - Кг = 0 и
![]() a= -
a= - ![]() +
+ 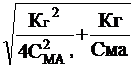
Второй корень уравнения не имеет физического символа, так как a не может быть меньше нуля.
Если степень гидролиза мала (a << 1), то 1-a » 1 и выражение (11) упрощается
Кг » С МА *a2; a » 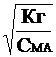 (12)
(12)
Смотрите также
Осмий - благородный металл
ОСМИЙ
(лат. Osmium), Os, химический элемент VIII группы периодической системы,
атомный номер 76, атомная масса 190,2, относится к платиновым металлам.
...
Разделение урана и тория с помощью тонкослойных неорганических сорбентов
Цель работы:
Концентрирование микроколичеств тория из
водного раствора соли уранила.
Уран и торий являются наиболее
распространенными природными радиоактивными элементами. Три естестве ...
Биологическое действие
В эпоху
научно-технической революции деятельность человека приобретает масштаб
геоэкологических процессов, приводит к изменению естественных биогеохимических
циклов на земле, нарушению экологическо ...


