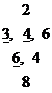Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Комплексные соединения.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Свойства d-элементов 4-го периода. / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Свойства d-элементов 4-го периода. / Комплексные соединения. Комплексные соединения.
Характерной особенностью соединений переходных металлов является способность к комплексообразованию, что объясняется наличием у ионов металла достаточного числа свободных орбиталей во внешнем и предвнешнем электронных уровнях.
В молекулах подобных соединений в центре находится комплексообразователь. Вокруг него координируются ионы, атомы или молекулы, называемые лигандами. Число их зависит от свойств комплексообразователя, степени его окисленности и называется координационным числом:
|
Заряд комплексообразователя |
Координационное число |
|
|
|
Комплексообразователь координирует вокруг себя лигандры двух типов: анионные и нейтральные. Образуются комплексы при соединении нескольких различных молекул в одну более сложную:
![]() сульфотетраамин меди (II)
сульфотетраамин меди (II) ![]() гексацианноферрат (III) калия.
гексацианноферрат (III) калия.
В водных растворах комплексные соединения диссоциируют, образуя комплексные ионы:
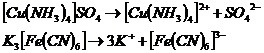
Сами комплексные ионы так же способны к диссоциации, но обычно в очень небольшой степени. Например:
![]()
Этот процесс протекает обратимо и равновесие его резко сдвинуто влево. Следовательно, согласно закону действия масс,
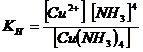
Константа Кн в подобных случаях называется константой нестойкости комплексных ионов. Чем больше величина константы, тем сильнее способность иона диссоциировать на составные части. Величины Кн приводятся в таблице: