Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Гидролиз солей.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Гидролиз солей. / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Гидролиз солей. / Гидролиз солей. Гидролиз солей.Страница 2
![]()
В случае гидролиза по аниону (например, для ![]() ) уравнение принимает вид:
) уравнение принимает вид:
![]() или
или ![]()
![]() - ионное произведение воды.
- ионное произведение воды.
Аналогично для гидролиза по катиону (например, для ![]() )
)
![]()
Для гидролиза по катиону и аниону получаем:
![]()
К реакциям гидролиза соли применимы все положения и законы о химическом равновесии. Равновесие процесса гидролиза, отвечающее равенству скоростей реакций гидролиза и нейтрализации (![]() ) подвижно и может быть смещено вправо (
) подвижно и может быть смещено вправо (![]() ) или влево (
) или влево (![]() ) в соответствии с принципом Ле Шателье. Так, например, при повышении температуры равновесия гидролиза смещается вправо, так как прямая реакция эндотермическая (
) в соответствии с принципом Ле Шателье. Так, например, при повышении температуры равновесия гидролиза смещается вправо, так как прямая реакция эндотермическая (![]() > 0), а обратная (нейтрализация) - экзотермическая (
> 0), а обратная (нейтрализация) - экзотермическая (![]() < 0).
< 0).
Связь между константой гидролиза соли (![]() ) и степенью гидролиза (
) и степенью гидролиза (![]() ) в растворе заданной концентрации (
) в растворе заданной концентрации (![]() ) выражается законом Оствальда:
) выражается законом Оствальда:
![]()
Рассмотрим несколько примеров (все расчеты выполняются с допущением С = а - равенство концентраций ионов их активностям).
ПРИМЕР 1.
Рассчитайте константу, и степень гидролиза соли ![]() в 0,001н растворе при 289К, учитывая только первую ступень процесса.
в 0,001н растворе при 289К, учитывая только первую ступень процесса.
Решение: соль ![]() образована сильным основанием и слабой кислотой, поэтому гидролизуются только ионы
образована сильным основанием и слабой кислотой, поэтому гидролизуются только ионы ![]() . Уравнение реакции:
. Уравнение реакции:
![]()
Константа равновесия процесса:
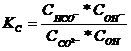
умноженная на концентрацию воды:
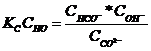
называется константой гидролиза соли. Ее вычисляют по формуле:
![]()
где ![]() - ионное произведение воды;
- ионное произведение воды;
![]() - константа диссоциации продукта гидролиза. Следовательно:
- константа диссоциации продукта гидролиза. Следовательно:
![]() =10-14/(4,8*10-11)
=10-14/(4,8*10-11)
Следует обратить внимание на то, что величина константы гидролиза, как и любой другой константы равновесия реакции, не зависит от концентрации растворенного вещества, а зависит лишь от температуры.
Степень гидролиза ![]() может быть вычислена по формуле:
может быть вычислена по формуле:
![]()
![]()
откуда ![]() или
или ![]()
ПРИМЕР 2.
Рассчитайте ![]() 0,1н раствора
0,1н раствора ![]() .
.
Решение: соль ![]() образована слабым основанием и сильной кислотой, поэтому гидролизуются ионы
образована слабым основанием и сильной кислотой, поэтому гидролизуются ионы ![]() . Уравнение реакции:
. Уравнение реакции:
![]()
при гидролизе хлорида аммония в растворе образуется избыток ионов водорода. Водородный показатель среды вычисляют по формуле:
![]()
![]() в растворе
в растворе ![]() равно концентрации прореагировавших ионов
равно концентрации прореагировавших ионов ![]()
Смотрите также
Разработка методов и средств реабилитации объектов отравляющих веществ
Обеспечение безопасности людей и защита окружающей среды (ОС)
являются основополагающими требованиями Конвенции о запрещении разработки,
производства, накопления и применения химического ору ...
Расчёт многокорпусной выпарной установки
В химической промышленности выпариванию подвергают
растворы твердых веществ (главным образом водные растворы щелочей, солей и
др.), а также растворы высококипящих жидкостей, обладающих при т ...


