Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Гидролиз солей.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Гидролиз солей. / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Гидролиз солей. / Гидролиз солей. Гидролиз солей.Страница 1
Гидролизом называются обменные химические реакции, протекающие с участием воды. Гидролизом соли называются, взаимодействие соли с водой. Приводящее к образованию слабого электролита (слабой кислоты, слабого основания, кислого или основного иона). В результате гидролиза в растворе накапливаются ![]() или
или ![]() ионы, поэтому растворы многих солей имеют кислую или щелочную реакцию среды.
ионы, поэтому растворы многих солей имеют кислую или щелочную реакцию среды.
Признаком гидролиза соли является изменение нейтральной реакции среды водного раствора. Например, при растворении в воде хлорида аммония ![]() образуется избыток ионов
образуется избыток ионов ![]() и раствор подкисляется (
и раствор подкисляется (![]() < 7):
< 7):
![]()
или ![]()
Однако не все соли вступают в реакцию гидролиза. Если растворить в воде хлорид калия ![]() . нейтральная реакция среды (
. нейтральная реакция среды (![]() =7), характерная для чистой воды, не изменяется, т.е. в растворе сохранится равенство
=7), характерная для чистой воды, не изменяется, т.е. в растворе сохранится равенство ![]() .
.
![]()
или ![]()
Можно утверждать, что соли, образованные сильным основанием и сильной кислотой (![]() ,
, ![]() ,
, ![]() и т.п.), в реакцию гидролиза не вступают.
и т.п.), в реакцию гидролиза не вступают.
С водой взаимодействуют:
1) соли, образованные слабыми основаниями и сильными кислотами. (![]() ,
, ![]() ,
, ![]() ,
, ![]() и т.п.).
и т.п.).
2) соли, образованные слабыми кислотами и сильными основаниями. (![]() ,
, ![]() ,
, ![]() , и т.п.).
, и т.п.).
3) соли, образованные слабыми основаниями и слабыми кислотами. (![]() ,
, ![]() и т.п.).
и т.п.).
Из рассмотренных примеров следует, что в реакции с водой вступают катионы слабых оснований и анионы слабых кислот. Если эти ионы многозарядные (Fe3+, Cu2+, ![]() ,
, ![]() и т.п.) их взаимодействие с водой обычно идет до образования основного или кислого иона (первая ступень гидролиза). Первая ступень гидролиза выражена наиболее сильно.
и т.п.) их взаимодействие с водой обычно идет до образования основного или кислого иона (первая ступень гидролиза). Первая ступень гидролиза выражена наиболее сильно.
Например:
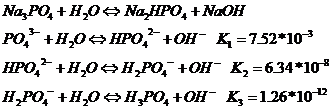
Количественно гидролиз характеризуется степенью гидролиза (![]() ) и константой гидролиза (
) и константой гидролиза (![]() ). Степень гидролиза представляет собой отношение числа молекул, подвергшихся гидролизу (С), к общему числу молекул данной соли (
). Степень гидролиза представляет собой отношение числа молекул, подвергшихся гидролизу (С), к общему числу молекул данной соли (![]() ).
).
![]()
Для солей, образованных сильным основанием и сильной кислотой ![]() =0. Для солей, образованных слабым основанием и слабой кислотой в разбавленных растворах
=0. Для солей, образованных слабым основанием и слабой кислотой в разбавленных растворах ![]() =100%.
=100%.
В общем виде реакцию гидролиза соли ![]() можно представить уравнением:
можно представить уравнением: ![]()
Константа равновесия этого процесса:
![]()
Так как [![]() ] в разбавленных растворах можно считать величиной постоянной то и произведение K*[
] в разбавленных растворах можно считать величиной постоянной то и произведение K*[![]() ] также постоянно. Эту величину называют константой гидролиза, т.е.
] также постоянно. Эту величину называют константой гидролиза, т.е.
Смотрите также
О спонтанном деформировании ацетатных волокон в парах нитрометана
Целлюлоза – один из
наиболее распространенных природных полимеров, широко используемых в различных
областях народного хозяйства. Также широко применяются производные целлюлозы,
особенно аце ...
Вред курения
Арабская
пословица гласит: « Кури, и тебя не укусит собака, потому что ты плохо пахнешь.
Кури - и тебя не ограбят, потому что ты испугаешь грабителей кашлем. Кури, и
тебе не грозит старость ...
Получение препаратов протеиназы penicillium wortmannii 2091 и
исследование их физико-химических свойств.
Известно, что
микроорганизмы синтезируют богатые набором ферментов комплексы. Поэтому важным
этапом в получении препаратов направленного действия является изучение условий
их выделения, очистки от ...


