Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электронная конфигурация
комплексообразователяОткрытая химия / Координационные соединения / Открытая химия / Координационные соединения / Электронная конфигурация
комплексообразователя Электронная конфигурация
комплексообразователяСтраница 2
Электронные конфигурации во многом предопределяют свойства и строение координационных соединений 3d-металлов.
3d0 (Sc3+, Ti4+, V5+, Cr6+, Mn7+) обычно образуют тетраэдрические тетраоксоанионы (![]()
![]()
![]()
![]() ) и октаэдрические [ScF6]3–, [TiF6]2–, [VF6]–.
) и октаэдрические [ScF6]3–, [TiF6]2–, [VF6]–.
3d1 (Ti3+, V4+ или VO2+, Cr5+, Mn6+), соединения Ti3+ обычно имеют октаэдрическое строение [TiCl6]3–, [Ti(H2O)6]3+, в водных растворах V4+ не существует, переходя в ванадил-ион с искаженной октаэдрической структурой [VO(H2O)5]2+. Соединения Cr5+ и Mn6+ обычно известны в виде анионов и
которые в водной среде диспропорционируют.
3d2 (Ti2+, V3+, Cr4+, Mn5+, Fe6+). В водных растворах они неустойчивы: [Ti(H2O)6]2+ – сильнейший восстановитель, и
– сильнейшие окислители. Они в этих степенях окисления существуют только в твердом состоянии.
3d3 (V2+, Cr3+, Mn4+). Из них наиболее устойчив Cr3+ в октаэдрических комплексах, которые относятся к инертным соединениям независимо от вида комплекса (катионного, анионного или нейтрального). Они интенсивно окрашены, поскольку основные полосы поглощения находятся в видимой области.
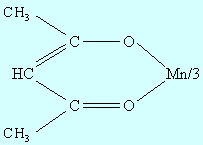
3d4 (Cr2+, Mn3+). В водных растворах гексааквакомплексы [Cr(H2O)6]2+ и [Mn(H2O)6]3+ неустойчивы; первый окисляется до [Cr(H2O)6]3+, а второй диспропорционирует 2Mn3+→ Mn2+ + Mn4+. Стабилизируют эту электронную конфигурацию двойные соли M2ISO4∙CrSO4∙6H2O (M = NH4+, Na+, K+, Rb+, Cs+), в которых Cr2+ остается высокоспиновым (S = 2) и бидентатные лиганды (dipy – дипиридил и phen – фентантролин ). Комплексы [Cr(dipy)3]X2 и [Cr(phen)3]X2 (X = Cl, Br, I) оказываются низкоспиновыми (S = 1). В моногидрате ацетата Cr (II) стабилизация электронной конфигурации обусловлена димеризацией (рис. 9.8).
 |
|
Рисунок 9.8 Димер моногидрата ацетата хрома (II) |
Межатомное расстояние Cr–Cr (0,264 нм) обусловлено образованием четверной связи между атомами хрома за счет всех четырех d-электронов.
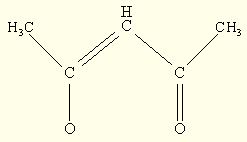
Соединения Mn (III) стабильны с лигандами, образующими металлоцикл, в частности с ацетилацетоном
|
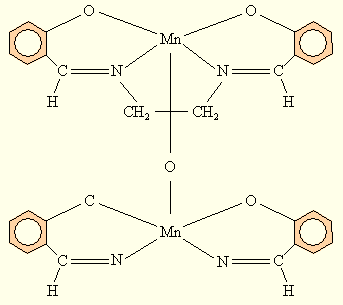
или с тетрадентатными плоскими лигандами типа N'N'-этилен-бис(салицилиденимином), в которых Mn(III) стабилизируется в результате димеризации с образованием μ-оксо соединения – μ-оксо-[N'N'этилен-бис(салицилидениминат) марганца (III)]
 |
|
Рисунок 9.11 μ-оксо[N,N'-этилен-бис(салицилидениминат) марганца(III)] |
Смотрите также
Участок по переработке лома твёрдых сплавов способом хлорирования
В настоящее время для производства режущих
инструментов широко используются твердые сплавы. Они состоят из карбидов
вольфрама, титана, тантала, сцементированных небольшим количеством кобальт ...
Свойства и получение цинка
Элемент цинк (Zn)
в таблице Менделеева имеет порядковый номер 30. Он находится в четвертом
периоде второй группы. Атомный вес - 65,37. Распределение электронов по слоям
2-8-18-2
Происхож ...
Атомно-молекулярное учение и его законы
Химия - наука о веществах, изучающая их состав, строение,
свойства, а также превращения веществ, на сопровождающиеся изменением состава
атомных ядер.
Использование для нужд человека природных рес ...