Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Устойчивость координационных
соединений в растворахОткрытая химия / Координационные соединения / Открытая химия / Координационные соединения / Устойчивость координационных
соединений в растворах Устойчивость координационных
соединений в растворах
Химические свойства комплексного иона с известной электронной конфигурацией и геометрическим строением определяются двумя факторами: а) способностью равновесной системы при определенных условиях к превращениям; б) скоростью, с которой могут происходить превращения, ведущие к достижению равновесного состояния системы.
Первый определяет термодинамическую, а второй – кинетическую устойчивость комплексного соединения. Кинетическая устойчивость зависит от многих факторов, поэтому обычно поддается лишь качественной оценке.
В противоположность ей термодинамическая устойчивость может быть легко охарактеризована количественно с помощью констант равновесия.
В растворе ион металла M и монодентатный лиганд L взаимодействуют ступенчато с образованием комплексного иона [MLn] по схеме:
| |
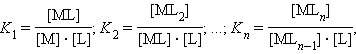 |
где Ki – ступенчатые константы образования (устойчивости) отдельных комплексов [MLi].
Поскольку в этой системе существует лишь n независимых равновесий, полная константа процесса M + nL = MLn – общая константа образования: ![]()
![]()
Чем больше константа устойчивости, тем более прочным является данный комплекс, поскольку ΔG° = –RT lnβ.
Образование прочных комплексных ионов может быть использовано для растворения труднорастворимых электролитов. Концентрация ионов в растворе определяется величиной произведения растворимости такого электролита. Добавляя в раствор вещества, образующие с одним из его ионов комплексное соединение, можно во многих случаях достичь растворения осадка за счет комплексообразования. Добиться этого тем легче, чем больше величина произведения растворимости и чем больше константа устойчивости комплексного иона. Например, хлорид серебра AgCl растворяется в избытке аммиака, образуя [Ag(NH3)2]Cl. Менее растворимый AgI в аммиаке практически не растворим, но растворяется в тиосульфате натрия Na2S2O3 по реакции
| |
поскольку β[Ag(S2O3)2]3– на несколько порядков больше β[Ag(NH3)2]+.
Комплексные ионы участвуют в реакциях обмена с образованием более прочного или менее растворимого соединения:
|
Здесь M = Ni2+, Cu2+, Fe2+.
Смотрите также
Пептиды и первичная структура белка
Пептиды и белки
представляют собой высокомолекулярные органические соединения, построенные из
остатков α-аминокислот, соединенных между собой пептидными связями.
Ни один из
известны ...
Витанолиды, их химическая природа
...
Экспериментальная часть
Реагенты
и оборудование.
Уравнение
реакции имеет вид:
Реактивы:
N-фенилантраниловая кислота (С13Н11О2N, M=213 г/моль, Тпл=179-1810С) – 3г,
серная кислота (Н2SО4, M=98.08 г/моль, Тпл=-13 ...


