Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Экспериментальное определение первичной структуры белкаДипломы, курсовые и прочее / Пептиды и первичная структура белка / Дипломы, курсовые и прочее / Пептиды и первичная структура белка / Экспериментальное определение первичной структуры белка Экспериментальное определение первичной структуры белкаСтраница 2
Далее в слабокислой среде происходит отщепление циклического производного N- концевой аминокислоты, а оставшийся неразрушенным пептид оказывается укороченным на один аминокислотный остаток, Указанное циклическое производное представляет собой фенилтиогидантоинаминокислоту (ФТГ-аминокислоту). Его идентифицируют методом хроматографии. Далее аминокислотный состав укороченного пептида (Arg, Asp, Gly2, Phe) сравнивают с исходным: (Ala, Arg, Asp, Gly2, Phe).
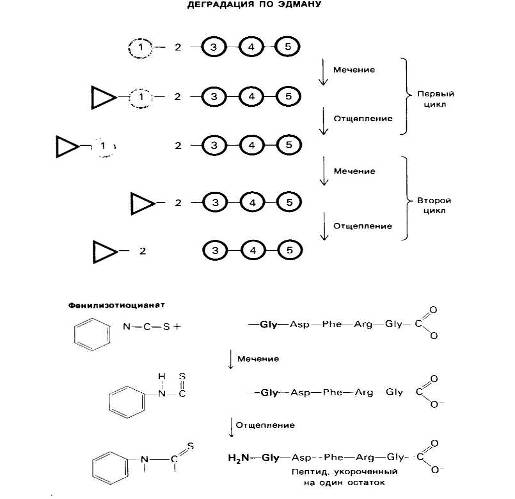 |
От пептидной цепи отщепляют меченый N-концевой остаток аминокислоты (ФТГ-аланин на первой ступени деградации). Остаток пептидной цепи при этом не гидролизуется. На второй ступени деградации определяют следующий N-концевой аминокислотный остаток. Еще три ступени деградации но Эдману позволят установить всю последовательность аминокислот во взятом пептиде.
Оказывается, что различие состоит в одном остатке аланина. Следовательно, в исходном пептиде аланин занимает N-концевое положение. Деградацию по Эдману можно вновь повторить па укороченном пептиде. Исходя из аминокислотного состава после второй ступени деградации
(Arg, Asp, Gly, Phe)
Можно поийти к выводу, что вторым остатком с N-конца является глицин, это заключение подтверждают путем хроматографической идентификации ФТГ-глицина, полученного на второй ступени деградации пептида. Еще три ступени деградации по Эдману позволяют полностью раскрыть последовательность аминокислот во взятом пептиде.
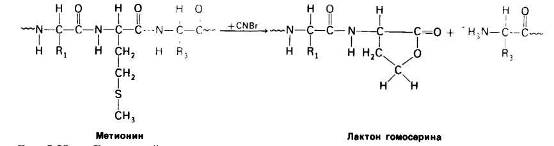
Стратегию анализа последовательности аминокислот в белках можно определить как «разделяй и властвуй». Белок подвергают специфическому расщеплению па более короткие пептиды, последовательность аминокислот в которых определяют по Эдману. Специфическое расщепление можно производить химическими или ферментативным методами. Так, Б. Уиткоп (В. Witkop) и Э. Гросс (Е. Gross) обнаружили, что бромистый циан (CNBr) расщепляет полипептидную цепь только по пептидной связи, образованной карбоксильной группой остатка метионина, Если в белке содержится 10 метиониновых остатков, то после обработки бромистым цианом обычно получается 11 пептидов. Высокоспецифическое расщепление достигается также с помощью трипсина-протеолитического фермента поджелудочной железы.
Трипсин расщепляет полипептидные цепи по пептидной связи, образованной карбоксильной группой остатков аргинина и лизина. В результате белок, содержащий 9 остатков лизина и 7 остатков аргинина, после расщепления трипсином распадается на 17 пептидов. Каждый из этих пептидов, кроме пептида, расположенною на карбоксильном конце белка, будет кончаться аргинином или лизином.
Пептиды, полученные при специфическом химическом или ферментативном расщеплении белка, разделяют методами хроматографии. Далее последовательность аминокислот в каждом из пептидов определяют методом Эдмана. Таким образом, достигается этап, когда последовательность аминокислот в отдельных пептидах (фрагментах белка) известна, но остается невыясненной последовательность самих пептидов. Последнюю устанавливают с помощью так называемых перекрывающихся пептидов. При этом используют уже не трипсин, а какой-либо фермент, расщепляющий полипептидную цепь в других участках, например химотрипсин, который расщепляет пептидные связи главным образом по карбоксильным группам ароматических и других больших неполярных аминокислотных остатков
|
|
Рис. 23 Бромистый циан расщепляет полипептиды по карбоксильной группе метиониновых остатков.
Пептиды, образующиеся под действием химотрипсина, неизбежно перекрывают два или более триптических пептида, что используется для установления их последовательности. Таким путем полностью определяют последовательность аминокислот в белке.
Описанные методы применимы к белкам, состоящим из одной полипептидной цепи, не имеющей дисульфидных связей. В тех же случаях, когда в белке имеются дисульфидные связи или более одной полипептидной цепи, то необходимы дополнительные методические приемы, Например, если белок содержит две или более полипептидные цепи, соединенные нековалентными связями, то, воздействуя денатурирующими агентами, такими, как мочевина или гуанидингидрохлорид, вызывают диссоциацию цепей. Диссоциированные цепи разделяют и только после этого приступают к определению последовательности аминокислот в каждой из них. Если же полипептидные цепи соединены ковалентными дисульфидными связями, как это имеет место в инсулине, то их окисляют надмуравьиной кислотой; при этом дисульфидные связи разрываются и образуются остатки цистеиновой кислоты.
Смотрите также
Химическое действие света. Фотография
Квантовым законам подчиняется поведение всех микрочастиц. Но
впервые квантовые свойства материи были обнаружены при исследовании излучения и
поглощения света.
Поглощается и излу ...
Основы метода потенциометрического
титрования.
Рассмотрим основные
понятия потенциометрического титрования, его виды и методы проведения, способы установления
точки эквивалентности при титровании. ...
Определение свойств газов
Общие сведения о свойствах
газов
В природе в
нормальных условиях (при комнатной температуре и атмосферном давлении)
сравнительно немногие химические вещества находятся в газообразном сос ...