Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Экспериментальное определение первичной структуры белкаДипломы, курсовые и прочее / Пептиды и первичная структура белка / Дипломы, курсовые и прочее / Пептиды и первичная структура белка / Экспериментальное определение первичной структуры белка Экспериментальное определение первичной структуры белкаСтраница 1
Рассмотрим, как можно определить последовательность аминокислот в коротком пептиде. Допустим, что пептид состоит из 6 аминокислотных остатков, расположенных в следующей последовательности:
Ala-Cly-Asp-Phe-Arg-Gly.
(Для обозначения аминокислот использованы общепринятые сокращения). Прежде всего необходимо определить аминокислотный состав пептида. Для этого его гидролизуют до составляющих аминокислот нагреванием до 110°С в течение 24 ч в 6 н. НС1. Далее аминокислоты полученного гидролиза разделяют методом ионообменной хроматографии на колонке с сульфонированным полистиролом. Фракционированные аминокислоты определяют по окраске, образующейся при нагревании с нингидрином: α-аминокислоты дают с нигидрином интенсивное синее окрашивание, а иминокислоты, например пролин, желтое[5].
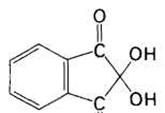
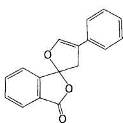
Рис. 17 нингидрин и флуорескамин
Метод ионообменной хроматографии обладает высокой чувствительностью:
|
|
рН 3,25 0,2 м Цитрат натрия
рН 4,25 0(2 м Цитрат натрия
рН 5,28 0,35 м Цитрат натрия
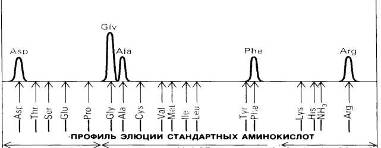
Рис.18 Элюция из колонки
С его помощью можно определить даже один микрограмм аминокислоты, т.е. примерно столько, сколько содержится в одном отпечатке пальца. Количество аминокислоты пропорционально оптической плотности раствора после нагревания с нингидринйм. Если требуется определить еще меньшие количества аминокислоты- порядка нескольких нанограммов, то используют флуорескамин, который реагирует с α-аминогруппой, образуя сильно флуоресцирующее соединение. О природе аминокислоты судят по объему элюции, т.е. по объему буфера, использованному для вымывания данной аминокислоты с колонки (рис. ). Сравнение результатов хроматографии гидролизата со стандартной смесью аминокислот свидетельствует о том, что исследуемый пептид имеет следующий аминокислотный состав:
(Ala, Arg, Asp, Gly2, Phe).
Скобки показывают, что речь идет о составе, а не последовательности аминокислот в пептиде.
|
|
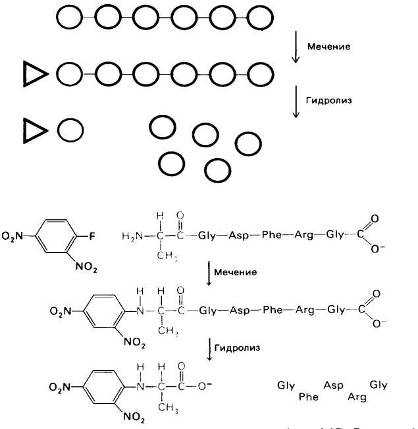
Рис.19 Определение N-концевого остатка пептида. Пептид метят фтординитробензолом (реактив Сэнгера) и затем гидролизуют. ДНФ-производное аминокислоты (в приведенном примере ДНФ-аланин) идентифицируют по хроматографиче-ским характеристикам.
Для определения в белке или пептиде концевого остатка, несущего аминогруппу, его метят с помощью соединения, образующего стабильную ковалентную связь с азотом аминогруппы (рис. 20).
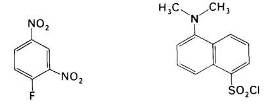
Рис. 20 фтординитробензол и дансилхлорид
Впервые для этой цели Сэнгер использовал фтординитробензол (ФДНБ), реагирующий с незаряженной a-NH2-группой с образованием динитрофенильного (ДНФ) производного пептида желтого цвета. Связь между ДНФ и концевой аминогруппой стабильна в условиях, используемых для гидролиза пептидных связей. Поэтому при гидролизе ДНФ-производного пептида Ala-Gly-Asp-Phe-Arg-Gly в 6 н. НСl высвобождается ДНФ-аминокислота, которую можно идентифицировать хроматографически как ДНФ-аланин.
Для идентификации N-концевых аминокислот в настоящее время часто используют дансилхлорид, который при взаимодействии с аминогруппой дает стабильное, интенсивно флуоресцирующее сульфамидное производное. Этот метод позволяет выявить N-концевую аминокислоту (после кислотного гидролиза пептидных
связей), присутствующую в таком незначительном количестве, как несколько нанограммов.
При всех достоинствах методов определения N-концевых аминокислотных остатков с помощью ДНФ или лансилхлорида их, к сожалению, нельзя использовать дважды применительно к одному и тому же пептиду, поскольку последний полностью распадается при кислотном гидролизе. Пьеру Эдману (P. Edman) удалось разработать метод маркирования N-концевого остатка и отщепления его от пептида без сопутствующего расщепления остальных пептидных связей. Деградация по Эдману (реакция Эдмана) состоит в ступенчатом (по одному) отщеплении аминокислотных остатков с аминоконца пептида, Фенилизотиоциа-нат реагирует с незаряженной концевой аминогруппой пептида с образованием фенилтиокарбамоильного производного
Смотрите также
Физико-химические основы хроматографического процесса
Газовая хроматография — один из
наиболее перспективных физико-химических методов исследования, бурно
развивающийся в настоящее время. Создание и успешная разработка различных
вариантов газо ...