Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Свойство водных растворов
электролитов.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Свойство водных растворов
электролитов. Свойство водных растворов
электролитов.
Цель работы: ознакомится с электропроводностью растворов, ионными равновесиями в растворах электролитов.
Согласно теории электролитической диссоциации электролиты при растворении в воде распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Этот процесс можно выразить уравнением:
![]()
Как видно из уравнения, этот процесс равновесный, а следовательно, константа равновесия может быть выражена через равновесные концентрации:
![]()
Константа равновесия характеризует диссоциацию вещества в растворах и носит название константа диссоциации.
Величина
![]() зависит от
природы электролита и растворителя, а также от температуры, но не зависит от
концентрации раствора.
зависит от
природы электролита и растворителя, а также от температуры, но не зависит от
концентрации раствора.
Константа
диссоциации (![]() )
является величиной, характеризующий способность электролита к диссоциации.
Например:
)
является величиной, характеризующий способность электролита к диссоциации.
Например:
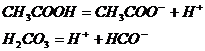
Константа диссоциации уксусной и угольной кислоты соответственно равны:
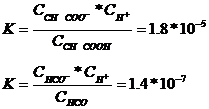
Сравнивая значения этих констант, можно сказать, что у угольной кислоты способность к диссоциации на ионы меньше, чем у уксусной.
Степень
диссоциации ![]() и
константа диссоциации
и
константа диссоциации ![]() слабого электролита связанны между собой
зависимостью (закона Оствальда):
слабого электролита связанны между собой
зависимостью (закона Оствальда):
![]()
где
![]() - разведение
раствора, л/моль.
- разведение
раствора, л/моль.
Все электролиты можно разделить на две группы: сильные и слабые электролиты. Сильные растворы в водных электролитах диссоциируют полностью. Слабые электролиты в водных растворах диссоциируют частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами.
В растворах электролитов осуществляется межионное взаимодействие, обусловленное силами притяжения и отталкивания. Наиболее заметны межионные взаимодействия в растворах сильных электролитов. Для количественной характеристики межионных взаимодействий используется ионная сила раствора I (полусумма произведений концентраций всех ионов, присутствующих в растворе, на квадрат их заряда):
![]()
Зная ионную силу раствора I, можно найти коэффициент f, позволяющий определить некоторую величину А (активность), формально заменяющую концентрацию С при математических описаниях свойств растворов электролитов:
![]()
![]() - коэффициент активности
иона, который является функцией ионной силы раствора I и заряда иона
- коэффициент активности
иона, который является функцией ионной силы раствора I и заряда иона ![]() .
.
Количественной
характеристикой способности электролита проводить электрический ток является
электрическая проводимость. Различают удельную ![]() и молярную
и молярную ![]() электрическую проводимость.
электрическую проводимость.
Сильные
электролиты диссоциируют в растворе полностью, но на границе малорастворимого
сильного электролита с раствором ионы из осадка переходят в раствор и вновь
возвращаются на поверхность твердого вещества, т.е. устанавливается равновесие
между осадком и его ионами. Например: ![]() .
.
Растворение вещества происходит до тех пор, пока не установится равновесие между осадком и его ионами в растворе. В момент наступления равновесия раствор становится насыщенным. Количественно это равновесие можно охарактеризовать константой равновесия:
![]()
Так как
концентрация твердой соли - величина постоянная, то, умножая величину константы
равновесия на эту концентрацию, мы получаем новую константу: ![]() .
.
Таким
образом, в насыщенном растворе малорастворимого электролита произведение
концентраций ионов является величиной постоянной при данной температуре. Эта
величина называется произведением растворимости ![]() :
: ![]() .
.
Зная
величину произведения растворимостей, можно вычислить концентрацию
труднорастворимого электролита в насыщенном растворе. Например: ![]()
![]()
откуда
![]() ионов
ионов ![]() . Здесь величину ПР,
можно рассчитать, выпадет или нет данное вещество в осадок. Например, если
0,001 моль
. Здесь величину ПР,
можно рассчитать, выпадет или нет данное вещество в осадок. Например, если
0,001 моль ![]() поместить
в 1л воды, то все это количество соли растворится, так как величина
поместить
в 1л воды, то все это количество соли растворится, так как величина ![]() меньше
меньше ![]() . Следовательно, этот
раствор будет не насыщенным.
. Следовательно, этот
раствор будет не насыщенным.
Смотрите также
Применение ЭВМ в технологии лекарственных препаратов
...
Радон, его влияние на человека
Везде и повсюду нас окружает атмосферный воздух. Из чего он
состоит? Ответ не составляет труда: из 78,08 процента азота, 20,9 процента кислорода,
0,03 процента углекислого газа, 0,00005 проц ...


