Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Химическое и адсорбционное
равновесие.Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Статьи и работы по химии / Выполнение лабораторных работ по химии в вузах / Химическое и адсорбционное
равновесие. Химическое и адсорбционное
равновесие.
Цель работы - изучение влияния различных факторов на химическое равновесие, изучение зависимости величины адсорбции от равновесной концентрации адсорбата.
Понятие
"химическое равновесие" применимо, только к обратимым реакциям. Химическим
равновесием называют такое состояние реагирующей системы, при котором скорость
прямой реакции V равна скорости обратной реакции V. Равенство ![]() является кинетическим
условием химического равновесия.
является кинетическим
условием химического равновесия.
Химическое
равновесие характеризуется постоянством для данных условий величины энергии
Гиббса системы. Равенство ![]() является термодинамическим условием
химического равновесия.
является термодинамическим условием
химического равновесия.
Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ степенях, равных их стехиометрическим коэффициентам, называется константой равновесия.
Для обратимой реакции.
![]()
константа равновесия имеет вид
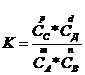
Константа
равновесия зависит от природы реагентов, температуры, и не зависит от исходной
концентрации веществ в системе. Константа равновесия связана со стандартной
энергией Гиббса данной реакции (![]() ) следующим соотношением:
) следующим соотношением:
![]()
где ![]() - универсальная
газовая постоянная [8,31 Дж/(моль*К)]; Т - абсолютная температура, К; Kc -
константа равновесия.
- универсальная
газовая постоянная [8,31 Дж/(моль*К)]; Т - абсолютная температура, К; Kc -
константа равновесия.
Химическое равновесие остается неизменным до тех пор, пока остаются постоянными параметры, при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ.
В общем случае направление смещения равновесия определяется принципом Ле Шателье:
если на систему, находящуюся в равновесии, оказывают внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Процесс поглощения одного вещества поверхностью другого называли адсорбцией. Вещество, частицы которого поглощаются (газ, жидкость, растворенный компонент), называют адсорбатом, а поглотитель адсорбентом.
Взаимодействие между частицами адсорбата и адсорбента могут иметь различный характер. В зависимости от природы этого взаимодействия различают адсорбцию физическую и химическую (хемосорбцию).
Процесс отрыва частиц адсорбата от поверхности адсорбента, т. е. явление обратное адсорбции, называют десорбцией. Если в системе "адсорбат - адсорбент" при заданных условиях скорость, адсорбции равна скорости десорбции, состояние системы называют адсорбционным равновесием.
Количественно адсорбцию выражают в молях адсорбата на единицу площади поверхности адсорбента (моль/м) или в молях адсорбата на единицу массы адсорбента (моль/г).
Экспериментальная часть.
Смотрите также
Равновесные и поляризационные диаграммы потенциал-pH
В настоящее время
большую важность имеет возможность оценивать устойчивость металлов и их сплавов
к коррозии в тех или иных условиях. Эту возможность позволяет реализовать на
практике приме ...


