Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Понятие о пептидах. Их строениеДипломы, курсовые и прочее / Пептиды и первичная структура белка / Дипломы, курсовые и прочее / Пептиды и первичная структура белка / Понятие о пептидах. Их строение Понятие о пептидах. Их строение
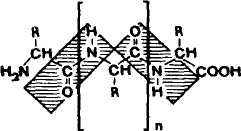
Пептиды — это цепочечные молекулы, содержащие от двух до ста остатков аминокислот, соединенных между собой амидными (пептидными) связями.
|
|
Рис.1 Строение пептида
Термин «пептиды» был предложен известным химиком Эмилем Фишером (1852—1919 гг.). Слово образовано из первых четырех букв названия пептоны (продукты расщепления белков пепсином) и конечных букв названия углеводов полисахариды.
По размеру молекулы и своим свойствам пептиды стоят между высокомолекулярными белками и аминокислотами. Наиболее распространены линейные пептиды, однако известны также циклические пептиды, молекулы которых могут иметь различные размеры. Циклические пептиды образуются из линейных, когда пептидная связь связывает амино- и карбоксильную функцию N- и С-концевых аминокислот.
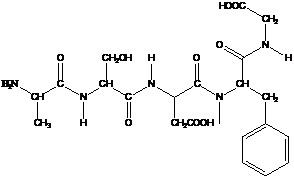
Полинг и Кори в 1951 г. показали с помощью рентгеноструктурного анализа аминокислот, амидов аминокислот и простых линейных пептидов, что пептидная связь С—N укорочена по сравнению с нормальной простой связью (рис. 2).
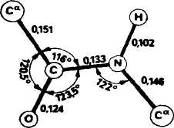
Рис. 2. Средние расстояния между атомами (нм), образующими пептидную связь и углы между связями.
Вследствие мезомерии получаются две устойчивые плоские конформации, транс (1) и цис (2), при затрудненном свободном вращении около связи С—N:

Рис.3 транс (1) и цис (2) пептиды
В 2,5-дикетопиперазинах, простейших циклических пептидах, построенных из двух аминокислот, имеются цис-пептидные связи. Циклические трипептиды могут существовать без напряжения также только с тремя цис-пептидными связями. Поскольку пролин и саркозин не обладают возможностью стабилизации транс-пептидиой связи, то можно легко синтезировать циклический трипептид — циклотрипролил. В нативных пептидах и белках преобладает транс-пептидная связь. В некоторых белках были найдены также и цис-пептидные связи, при этом в образовании пептидной связи всегда участвовал пролин [1].
Смотрите также
Мутации структуры белковоподобного сополимера. Компьютерное моделирование
...
Прогнозирование критической температуры. Алканы и алкены
...
Капельный анализ
В современной
аналитической химии наиболее приемлемыми являются методы для выполнения,
которых не требуется сложной аппаратуры и дефицитных затрат реактивов. Так же
важным фактором является ...