Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Основные факторы влияющие на ход процесса нуклеофильного
замещенияДипломы, курсовые и прочее / Технология нуклеофильного замещения функциональных групп в органических соединениях / Дипломы, курсовые и прочее / Технология нуклеофильного замещения функциональных групп в органических соединениях / Основные факторы влияющие на ход процесса нуклеофильного
замещения Основные факторы влияющие на ход процесса нуклеофильного
замещенияСтраница 2
Пространственные факторы при нуклеофильном замещении в ароматическом ряду не являются определяющими, так как атака направлена сбоку к плоскости ароматического ядра.
В зависимости от природы галогена порядок реакционной способности алкилгалогенидов в реакциях нуклеофильного замещения оказывается следующим: RI> RВr> RСI> RF. Иное положение наблюдается для является не переходным состоянием, а промежуточным соединением. Величина положительного заряда у реакционного центра зависит не только от количества, расположения и природы других заместителей в ядре, но и от природы замещаемого галогена. Поэтому в активированных ароматических системах атомы галогена могут быть замещены с возрастающей легкостью в ряду I < Вr < СI < F.[13]
Реакционная способность реагента по отношению к галогенпроизводным в реакциях может быть определена как его нуклеофильность. Нуклеофильность агентов зависит от их основности, поляризуемости и сольватации. При переходе от протонных к апротонным растворителям, а также к реакциям в газовой фазе относительная реакционная способность нуклеофилов существенно меняется.
Влияние растворителя в реакциях нуклеофильного замещения очень велико. Переходное состояние SN1 процесса значительно более полярно, чем исходные вещества. Поэтому увеличение полярности должно приводить к росту скорости диссоциации, а следовательно, и к увеличению скорости процесса в целом. Наряду с неспецифической сольватацией большую роль играет специфическая сольватация, и в первую очередь стабилизация уходящего галогенид - аниона за счет образования водородных связей с растворителем.
Что касается выбора растворителя для SN2 реакции, то в этом случае необходимо рассмотреть распределение зарядов в исходном и переходном. В соответствии с теорией Хьюза и Ингольда, реакции биомолекулярного замещения можно разбить на четыре типа по способу распределения зарядов и предсказать эффект увеличения полярности среды:
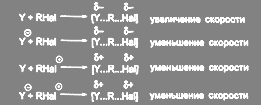 (15)
(15)
Наиболее распространенными являются первые два типа реакции. Изложенный подход, однако, не учитывает важности специфической сольватации реагентов, тогда как уменьшение специфической сольватации нуклеофила является одной из основных причин ускорения реакций бимолекулярного замещения типа анион — молекула в апротонных растворителях. Влияние природы растворителя в реакциях нуклеофильного замещения настолько велико, что в ряде случаев определяет протекание реакции по SN 1 или по SN 2 механизму.
К числу полярных растворителей, способствующих протеканию реакций по SN1 механизму, относятся протонные растворители: вода, спирты, карбоновые кислоты, аммиак. В реакциях нуклеофильного замещения они сольватировать как катионы, так и анионы. Тенденция к образованию водородных связей растет с увеличением кислотности растворителя.
Многие реакции, протекающие в слабо сольватирующих растворителях по бимолекулярному механизму, могут при использовании в качестве растворителя муравьиной или трифторуксусной кислоты идти по SN 1 типу.
К числу нуклеофильных растворителей, которые сольватируют главным образом катион, можно отнести такие апротонные соединения, как ацетон, ацетонитрил, нитрометан, диметилформамид, диметилсульфоксид, диглим и др. Они не сольватируют уходящих галогенид—ионов, а потому не способствуют протеканию SN1 реакции SN2 реакции, напротив, легко протекают в этих растворителях, так как в лимитирующей скорость стадии анионов не образуется.
Способностью стабилизации анионов (за счет комплексообразования) обладают кислоты Льюиса (галогениды бора, алюминия, цинка, сурьмы, ртути, серебра, а также ион серебра). Эти соединения применяются обычно как катализаторы для SN1 реакций. Стабилизация катиона при этом осуществляется путем взаимодействия с реагентом или растворителем.
Помимо уже перечисленных факторов при выборе растворителей необходимо учитывать их растворяющую способность по отношению к реагенту и субстрату. Во многих случаях при осуществлении реакций нуклеофильного замещения в качестве реагентов используются неорганические и органические соли, хорошо растворимые в воде и плохо растворимые в органических растворителях. для проведения таких реакций в гомогенных условиях традиционно применяют растворители, которые проявляют одновременно липофильные и гидрофильные свойства, например метанол, ацетон, этанол, ацетон, диоксан. Трудность при этом заключается в том, что соли менее растворимы в этих растворителях, чем в воде, а органические субстраты обычно менее растворимых в них, чем в углеводородах. Указанную проблему можно частично решить, используя смеси упомянутых выше растворителей с водой. Более эффективным оказывается применение таких диполярных, апротонных, катионсольватирующих растворителей, как диметилсульфоксид, диметилформамид, ацетонитрил, которые хорошо растворяют как соли, так и органические субстраты. Важным методом интенсификации процессов нуклеофильного замещения является межфазный катализ (МФК). Суть метода заключается в искусственном создании двухфазной системы, в которой неполярные и ионные реагенты находятся в разных фазах. Обычно это органическая фаза и водная фаза. Для переноса реагентов (нуклеофилов) служат межфазные катализаторы — источники липофильных катионов. Их роль заключается в образовании липофильных ионных пар "катион катализатора — реагирующий анион, способных к миграции внутрь органической фазы, где и происходит реакция. В применяемых для этой цели апротонных неполярных растворителях, не смешивающихся с водой, реагирующие анионы практически не сольватированы и обладают высокой реакционной способностью. Иногда в качестве органической фазы используют субстрат.[8]
Смотрите также
Зарождение химии
Представления древнегреческих
натурфилософов оставались ос-новными идейными истоками естествознания вплоть
до XVIII в. До начала эпохи Возрождения в науке господствовали представления
А ...
Определение состава стиральных порошков
Ещё лет
10-15 назад название используемых синтетических моющих средств (СМС), в особенности
стиральных порошков можно было легко перечислить: Астра, Эра, Лотос, так как их
набор не отличалс ...


