Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Анализ двухкомпонентных растворовДипломы, курсовые и прочее / Рефрактометрический метод анализа в химии / Дипломы, курсовые и прочее / Рефрактометрический метод анализа в химии / Анализ двухкомпонентных растворов Анализ двухкомпонентных растворов
По значению показателя преломления бинарного раствора можно определить его концентрацию. Для этого необходимо, чтобы была известна зависимость показателя преломления от состава раствора. Для ряда растворов (например, сахарозы, некоторых спиртов, кислот, оснований, солей) зависимости показателей преломления установлены и сведены в таблицы, которыми и пользуются при количественном анализе. Если таких таблиц нет, то используют градуировочные графики, которые строят по результатам измерений эталонных растворов.
Кривые зависимостей показателя преломления от состава бинарных растворов существенно изменяются с изменением природы раствора. Эти кривые подразделяют на три типа:
I тип – изотермы, имеющие незначительную положительную или отрицательную кривизну, когда изменение n от состава отличается от линейного хода по величине не более, чем на 0,0075-0,008 (рис. 4а);
II тип – изотермы, имеющие заметную кривизну, когда Δn > 0,008 (рис. 4б);
III тип – изотермы с сингулярной точкой (рис. 4в).
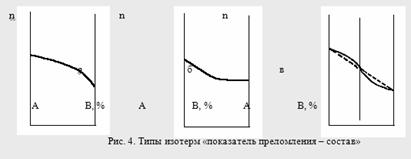
Большинству бинарных растворов соответствуют кривые I-го типа. Сюда относятся нормальные растворы и растворы с ассоциированными компонентами, а также растворы с химическим взаимодействием компонентов и растворы, в которых по каким-либо причинам такое взаимодействие не проявляется отчётливо на изотерме "показатель преломления – состав".
К растворам типа II и III относятся растворы с сильно выраженным химическим взаимодействием компонентов и с образованием частично диссоциированных соединений. В некоторых случаях по положению сингулярной точки на кривой III-го типа удаётся определить стехиометрический состав образовавшегося соединения.
Таким образом, в рефрактометрии двухкомпонентных систем, используется помимо количественного физико-химический метод анализа, который позволяет обнаружить достаточно выраженное взаимодействие компонентов. При отсутствии межмолекулярного взаимодействия, приводящего к ассоциации компонентов, справедливо свойство аддитивности рефракции. В этом случае молярная рефракция раствора RР равна сумме произведений рефракций его компонентов и их мольных долей в этом растворе:
Rp = N1∙R1 + N2∙R2,
где R1 и R2 – молярные рефракции соответственно растворителя и растворённого вещества; N1 и N2 – мольные доли растворителя и растворённого вещества.
Для расчёта RР с использованием экспериментальных данных по уравнению (15) необходимо знать величины "среднемолекулярной массы" раствора, которая определяется соотношением:
Мср = N1∙M1 + N2∙M2,
где M1 и М2 – молекулярные массы компонентов раствора, N1 и N2 - мольные доли компонентов раствора.
Свойством аддитивности, подобно молекулярной рефракции, обладает и удельная рефракция:
![]() (40)
(40)
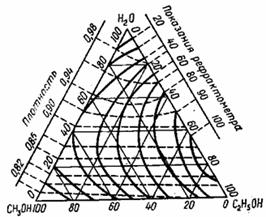
Рис. 5. Треугольная диаграмма для рефрактометрического анализа тройной системы: этиловый спирт - метиловый спирт - вода
Смотрите также
Эпитаксиальный рост Ge на поверхности Si(100)
С физикой
тонких пленок связаны достижения и перспективы дальнейшего развития
микроэлектроники, оптики, приборостроения и других отраслей новой техники.
Успехи микроминиатюризации электронн ...
Разработка методов и средств реабилитации объектов отравляющих веществ
Обеспечение безопасности людей и защита окружающей среды (ОС)
являются основополагающими требованиями Конвенции о запрещении разработки,
производства, накопления и применения химического ору ...
Прогнозирование критической температуры. Алканы и алкены
...


