Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Неорганические соединенияСтатьи и работы по химии / Барий / Статьи и работы по химии / Барий / Неорганические соединения Неорганические соединенияСтраница 2
Ba(OH)2— белый порошок с плотностью 4,495 г/см3 и т. пл. 408°. В катодных лучах гидроокись бария фосфоресцирует желто-оранжевым цветом. Растворяется в воде, трудно растворима в ацетоне и метплацетате.
При растворении Ва(ОН)2 в воде получается бесцветный раствор с сильно щелочной реакцией — баритовая вода, которая в присутствии двуокиси углерода быстро покрывается поверхностной пленкой карбоната бария.
Известны кристаллогидраты Ва(ОН)2*8Н2О, Ва(ОН)2*7H2O, Ва(ОН) •2Н2O и Ва(ОН)2*H2O. Кристаллогидрат Ва(ОН)2*8H2O выделяется в виде бесцветных моноклинных призм с плотностью 2,18 г/cм3 и т. пл. 78°. При нагревании до 650° в токе воздуха кристаллогидрат превращается в окись или перекись бария.
Пропускание хлора через баритовую воду сопровождается образованием хлорида, хлората и очень незначительных количеств гино-хлорита бария:
6Ва(ОН)2 + 6CL2 = 5BaCl2 + Ва(ClO3)2 + 6H2О
Баритовая вода реагирует при 100° с сероуглеродом:
2Ва(ОН)2 + CS2 =
ВаСО3 + Ba(HS)2 + H2O
Металлический алюминий взаимодействует с баритовой водой с образованием гидроксоалюмината бария и водорода:
2Аl + Ва(ОН)2 + 10H2O = Ba[Al(OH)4(H2O)2]2+3H2
Выше 1000° гидроокись бария подвергается термической диссоциации:
Ва(ОН)2 → ВаО + Н2O
Баритовая вода Ва(ОН)2 применяется в качестве очень чувствительного химического реактива на двуокись углерода.
Фторид бария, BaF2, получают непосредственным синтезом из элементов, действием фтористого водорода на окись, гидроокись, карбонат или хлорид бария, обработкой баритовой воды фтористо-водородной кислотой, обработкой нитрата или хлорида бария фто-ридом натрия или калия, а также сплавленном хлорида магния с фторидом кальция или магния в атмосфере CO2 и термическим разложением гексафторосиликата бария в атмосфере инертного газа:
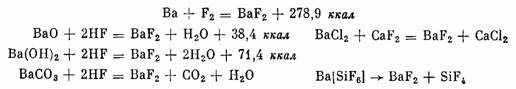
Бесцветные кубические кристаллы BaF2 имеют решетку типа CaF2 с расстоянием между центром иона Ва2+ и иона Fֿ 2,68 А. Плотность 4,83 г/см3, т.пл. 1280°, т. кип. 2137°. Кристаллы мало растворимы в воде (1,63 г/л при 18°), растворяются в фтористоводо-родной, соляной и азотной кислотах. Применяются для изготовления эмалей и оптических стекол. Температура плавления смеси BaF2*LiF 850°, а смеси BaF2*BaCl2 1010°.


