Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Исследование уравнений реакцийДипломы, курсовые и прочее / Дипломы, курсовые и прочее / Исследование уравнений реакций Исследование уравнений реакцийСтраница 3
Потенциал гальванического элемента:
Е = Е0катода – Е0анода =0,80 – (-0,763)=1,562В
Ответ: 1,562 В.
8. Изделие из алюминия склёпано медью. Какой из металлов будет подвергаться коррозии с водородной деполяризацией, если эти металлы попадут в кислую среду (
HCl
)? Составьте уравнения проходящих при этом процессов, приведите схему образующегося гальванического элемента. Определите продукты коррозии
В реакциях с кислотами атомы алюминия окисляются ионами водорода в ионы алюминия, которые переходят в раствор:
2Al+6H+→2Al3+ +3H2h
Медь в электрохимическом ряду напряжения металлов находится за водородом, (т.е. её стандартный потенциал положительный) и с разбавленными кислотами не реагирует (положительно заряженные ионы меди не переходят в раствор).
В кристаллической решетке меди (в отличие от алюминия) свободные электроны не накапливаются. При соприкосновении этих двух металлов свободные электроны алюминия переходят к меди и восстанавливают на её поверхность ионы водорода:
2H+ +2e→H2h
Продуктами коррозии будет являться результат взаимодействия алюминия с соляной кислотой:
2Al+6HCl→2AlCl3+3H2h
Образуется гальванический элемент:
(–) Al |AlCl3|Cu(+)
Анод катод.
9. При электролизе водных растворов каких из приведённых ниже веществ на катоде выделяется только металл: хлорид бария, хлорид меди (
II
), иодид калия, нитрат серебра, сульфид натрия? Приведите соответствующие уравнения электродных процессов
При электролизе водных растворов катионов металлов, у которых стандартный электродный потенциал больше чем водорода (Е0>>-0,41В) на катоде восстанавливаются только катионы металлов. В данном случае это хлорид меди (II) и нитрат серебра:
|
(–) Катод
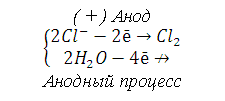
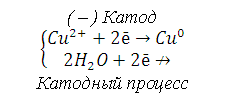
 |
Суммарный процесс электролиза:
![]()
Суммарный процесс электролиза:
![]()
Суммарное молекулярное уравнение электролиза:
![]() .
.
Смотрите также
Принципы определения примесей арсена в неизвестном минерале
В условиях активного загрязнения окружающей
среды и реальности экологического кризиса возрастает значение научных
исследований, направленных на изучение состояния экосистемы, и практического ...
Химический состав минеральных вод
Лечебными минеральными водами называются природные воды, которые
содержат в повышенных концентрациях те или другие минеральные (реже
органические) компоненты и газы и (или) обладают какими-н ...
Химические свойства ароматических углеводородов. Полиядерные ароматические соединения
Реакции электрофильного замещения:
галогенирование, нитрование, сульфирование, алкилирование, ацилирование.
Механизм реакции электрофильного замещения. Понятие о p- и s-комплексах, их строен ...


