Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Промышленная водоподготовкаДипломы, курсовые и прочее / Вода в химической промышленности / Дипломы, курсовые и прочее / Вода в химической промышленности / Промышленная водоподготовка Промышленная водоподготовкаСтраница 1
вода химический коллоидный водоподготовка
Вредное влияние примесей, содержащихся в промышленной воде, зависит от их химической природы, концентрации, дисперсного состояния, а также технологии конкретного производства использования воды. Все вещества, присутствующие в воде, могут находиться в виде истинного раствора (соли, газы, некоторые органические соединения в коллоидном состоянии) и во взвешенном состоянии (глинистые, песчаные, известковые частицы).
Растворенные в воде вещества образуют при нагревании накипь на стенках аппаратуры и вызывают коррозионное разрушение ее. Коллоидные примеси вызывают загрязнение диафрагмы электролизеров, вспенивание воды. Грубодисперсные взвеси засоряют трубопроводы, снижают их производительность, могут вызвать их закупорку. Все это вызывает необходимость предварительной подготовки воды, поступающей на производство - водоподготовку.
Промышленная водоподготовка представляет собой комплекс операций, обеспечивающих очистку воды - удаление из нее вредных примесей, находящихся в молекулярно-растворенном, коллоидном и взвешенном состоянии. Основные операции водоподготовки: очистка от взвешенных веществ отстаиванием и фильтрованием, умягчение, в отдельных случаях - обесцвечивание, нейтрализация, дегазация и обеззараживание.
Процесс отстаивания позволяет осветлять воду вследствие удаления из нее грубодисперсных веществ, оседающих под действием силы тяжести на дно отстойника. Отстаивание воды проводится в непрерывно- действующих отстойных бетонированных резервуарах. Для достижения полноты осветления и обесцвечивания декантируемую из отстойника воду подвергают коагуляции с последующим фильтрованием.
Коагуляция - высокоэффективный процесс разделения гетерогенных систем, в частности, выделение из воды мельчайших глинистых частиц и белковых веществ. Осуществляют коагуляцию введением в очищаемую воду небольших количеств электролитов Al2(S04)3> FеS04 и др. соединений, называемых коагулянтами. Физико-химическая сущность этого процесса в упрощенном виде состоит в том, что коагулянт в воде превращается в агрегат несущих заряд частиц, которые взаимодействуя с противоположно заряженными частицами примесей, обуславливают выпадение нерастворимого коллоидного осадка. Так, А12(Б04)3 в результате гидролиза и взаимодействия с солями кальция и магния, растворенными в воде, образует хлопьевидные положительно заряженные частицы А1(0Н)3
А12 (Б04) 3 +6 Н20 = 2А1(0Н) 3 +3Н20 Н2S04 + Са(НС03)2 = СаS04 +2Н20 +2С02
Взаимодействие положительно заряженных частиц гидроокиси алюминия и несущих отрицательный заряд примесей приводит к быстрой коагуляции. Одновременно идет процесс адсорбции на поверхности осадка органических красящих веществ, в результате чего вода обесцвечивается. Обеззараживание воды обеспечивается ее хлорированием или озонированием. Дегазация — удаление из воды растворенных газов достигается химическим способом, при котором газы поглощаются химическими реагентами, например, в случае диоксида углерода:
СО2 + Са(ОН)2 = СаСО3 +Н2О,
или физическими способами - термической деаэрацией на воздухе или в вакууме. Одной из основных и обязательных операций водоподготовки технологической воды является ее умягчение.
Схема промышленной водоподготовки
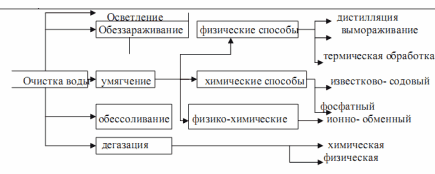
Умягчением называется обработка воды для понижения ее жесткости, т.е. уменьшения концентрации ионов кальция и магния различными физическими, химическими и физико-химическими методами.
При физическом методе воду нагревают до кипения, в результате чего растворимые гидрокарбонаты кальция и магния превращаются в их карбонаты, выпадающие в осадок:
Са(НСО3)2 = СаСО3 + Н2О +СО2.
Этим методом удаляется только временная жесткость.
К химическим методам умягчения относятся фосфатный и известково-содовый, заключающийся в обработке тринатрийфосфатом или смесью гидроксида кальция и карбоната натрия. В первом случае протекает реакция образования нерастворимого трикальцийфосфата, выпадающего в осадок:
3СаS04 + 2 Na3Р04 = 3Nа2S04 + Са3 (Р04) 2
Во втором случае протекают две реакции. Бикарбонаты кальция и магния реагируют с гидроксидом кальция, чем устраняется временная жесткость: Са(НС03)2 + Са(0Н)2 = 2 СаС03 +2 Н20 , а сульфаты, нитраты и хлориды - с карбонатом натрия, чем устраняется постоянная жесткость:
Смотрите также
Методы выделения и анализа кумаринов в лекарственное растительное сырьё
Физиологическая роль кумаринов до конца не установлена. Известно, что они
участвуют в регуляции роста растений, являясь антагонистами ауксинов; поглощают
ультрафиолетовые лучи, защищая молод ...


