Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Расчет термодинамических функцийДипломы, курсовые и прочее / Получение аллилового спирта гидролизом хлористого аллила / Дипломы, курсовые и прочее / Получение аллилового спирта гидролизом хлористого аллила / Расчет термодинамических функций Расчет термодинамических функцийСтраница 1
Изменение энтальпии при указанной температуре определяется по уравнению Кирхгоффа:
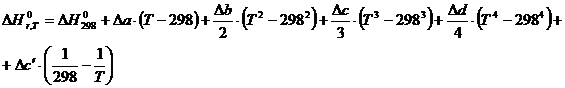
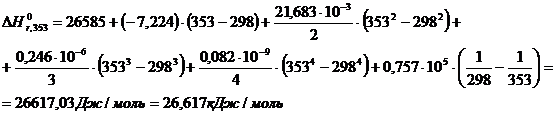
Изменение энтропии реакции рассчитывают по формуле:
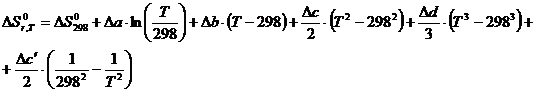
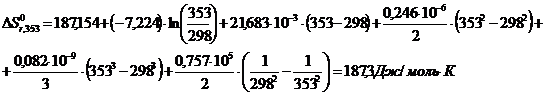
Изменение изобарно-изотермического потенциала рассчитывается по уравнению:
![]()
![]()
Константа равновесия реакции при заданных температурах определяется по уравнению нормального химического сродства:
![]()
![]()
![]()
Расчет всех термодинамических величин для температур от 353 до 463 К с шагом в 10 0С представлен в табл. 3.
Таблица 3
Термодинамические функции реакции
| № п/п | Т, К |
ΔН0r,T, кДж/моль |
ΔS0 r,T, Дж/моль·К |
ΔG0r,T, кДж/моль |
lnKp |
Кр |
|
1 |
353 |
26,617 |
187,25 |
-39,482 |
13,45 |
7,00·105 |
|
2 |
363 |
26,545 |
187,28 |
-41,438 |
13,73 |
9,18·105 |
|
3 |
373 |
26,642 |
187,32 |
-43,228 |
13,94 |
1,13·106 |
|
4 |
383 |
26,658 |
187,36 |
-45,101 |
14,16 |
1,41·106 |
|
5 |
393 |
26,675 |
187,41 |
-46,977 |
14,38 |
1,76·106 |
|
6 |
403 |
26,694 |
187,45 |
-48,848 |
14,58 |
2,15·106 |
|
7 |
413 |
26,715 |
187,51 |
-50,727 |
14,77 |
2,60·106 |
|
8 |
423 |
26,739 |
187,56 |
-52,599 |
14,96 |
3,14·106 |
|
9 |
433 |
26,764 |
187,62 |
-54,475 |
15,13 |
3,72·106 |
|
10 |
443 |
26,791 |
187,68 |
-56,351 |
15,30 |
4,41·106 |
|
11 |
453 |
26,820 |
187,75 |
-58,231 |
15,46 |
5,18·106 |
|
12 |
463 |
26,852 |
187,82 |
-60,109 |
15,62 |
6,08·106 |
Смотрите также
Нестероидные противовоспалительные препараты. Салицилаты
...
Свойства титана и его соединений
Титан находится в побочной
подгруппе четвертой группы, следовательно относится к переходным элементам.
Переходные элементы обладают определенными схожими свойствами.
Общая характеристика
...


