Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Благородные газыОткрытая химия / Химические свойства элементов / Открытая химия / Химические свойства элементов / Благородные газы Благородные газыСтраница 2
Соединения с валентными связями Э (II), Э (IV), Э (VI), Э (VIII) хорошо изучены на примере фторидов Kr и Xe, полученных по схеме
| |
Химическая связь в соединениях благородных газов не может быть описана с позиций МВС, поскольку в соответствии с этим методом в образовании связи должны участвовать d-орбитали. Однако возбуждение одного электрона с p- на d-орбиталь требует для ксенона около 100 кДж/атом, что не компенсируется энергией образования связи.
В рамках ММО строение XeF2 объясняется схемой, в которой d-орбитали не участвуют:
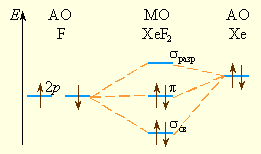 |
|
Рисунок 8.9 |
Тетрафторид ксенона является сильным окислителем:
| |
| |
При нагревании и гидролизе XeF4 диспропорционирует:
| |
Для шестивалентного Xe известны фторид XeF6, оксид XeO3, XeOF4 – оксофторид, Xe(OH)6 – гидроксид, а также комплексные ионы типа и
XeO3 хорошо растворим в воде и образует сильную кислоту
| |
Гексафторид очень активен, реагирует с кварцем:
| |
Производные Xe (VI) – сильные окислители, например:
| |
Для Xe (VIII) известны, кроме того, XeF8, XeO4, XeOF6, ![]()
В обычных условиях XeO4 медленно разлагается:
|
Смотрите также
Реакция катализа и промышленные катализаторы
...
Эволюционная химия - высшая ступень развития химических
знаний. Ближайшие перспективы химии
До недавнего
времени об эволюционной химии ничего не было известно. В отличие от биологов,
химиков не интересовал вопрос о «происхождении видов» вещества, потому что
получение любого ново ...


