Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Определение порядка реакцииДипломы, курсовые и прочее / Растворение твердых веществ / Дипломы, курсовые и прочее / Растворение твердых веществ / Определение порядка реакции Определение порядка реакцииСтраница 1
химический процесс растворение
Для определения порядка реакции нужно провести не менее двух периодических опытов при одной и той же температуре, но при различных начальных концентрациях активного реагента ![]() ≠
≠![]() . В этих опытах определяют зависимости доли нерастворившегося компонента от продолжительности растворения
. В этих опытах определяют зависимости доли нерастворившегося компонента от продолжительности растворения ![]() и
и ![]() . Кроме того, необходима информация об изменении концентрации активного реагента в ходе растворения, т.е. зависимости
. Кроме того, необходима информация об изменении концентрации активного реагента в ходе растворения, т.е. зависимости ![]() и
и ![]() , где
, где ![]() и
и ![]() - текущие концентрации активного реагента в первом и втором опытах. Эти зависимости могут быть получены либо прямыми измерениями (в тех же опытах), либо расчетным путем, исходя из стехиометрических соотношений. При этом необходимо учитывать, что данные полученные расчетным путем дают, как правило большую ошибку, чем экспериментальные данные (при условии грамотной постановки эксперимента). Затем по экспериментальным данным строят зависимость
- текущие концентрации активного реагента в первом и втором опытах. Эти зависимости могут быть получены либо прямыми измерениями (в тех же опытах), либо расчетным путем, исходя из стехиометрических соотношений. При этом необходимо учитывать, что данные полученные расчетным путем дают, как правило большую ошибку, чем экспериментальные данные (при условии грамотной постановки эксперимента). Затем по экспериментальным данным строят зависимость ![]() от
от ![]() , где
, где ![]() и
и ![]() отвечают равным значениям
отвечают равным значениям ![]() и
и ![]() . Из уравнений для скорости растворения (12) при равных значениях
. Из уравнений для скорости растворения (12) при равных значениях ![]() следует соотношение:
следует соотношение:
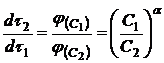 (16)
(16)
откуда
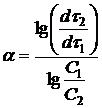 (16а)
(16а)
Уравнение (16) относится к произвольному, но фиксированному значению ![]() . Отношение приращений
. Отношение приращений ![]() и текущие концентрации активного реагента
и текущие концентрации активного реагента ![]() и
и ![]() должны быть определены в точках, отвечающих этим значениям. Как и в случае определения энергии активации по уравнениям (14) и (15) вычисления по уравнению (16) или (16а) можно выполнить для целого ряда значений
должны быть определены в точках, отвечающих этим значениям. Как и в случае определения энергии активации по уравнениям (14) и (15) вычисления по уравнению (16) или (16а) можно выполнить для целого ряда значений ![]() и за тем усреднить полученные результаты. При этом необходимо помнить, что расхождения результатов параллельных изменений не должны превышать 10%.
и за тем усреднить полученные результаты. При этом необходимо помнить, что расхождения результатов параллельных изменений не должны превышать 10%.
Из изложенного выше следует, что определение порядка реакции много сложнее чем определение энергии активации, так как требует численного или графического дифференцирования полученной из опытов зависимости ![]() . Причина этого усложнения ясна: концентрация активного реагента в периодическом опыте, как правило, может изменяться в больших интервалах. В тоже время температуру в ходе опыта можно легко поддерживать постоянной, в пределах
. Причина этого усложнения ясна: концентрация активного реагента в периодическом опыте, как правило, может изменяться в больших интервалах. В тоже время температуру в ходе опыта можно легко поддерживать постоянной, в пределах ![]() . Определение порядка реакции можно упростить, если концентрацию активного реагента в ходе периодического опыта не изменять. Это достигается путем восполнения убыли реагента в ходе растворения (периодическое дозирование), или сделать это изменение пренебрежимо малым, проводя опыт с очень большим избытком активного реагента. Этого можно достичь предварительным расчетом, чтобы даже при полном растворении твердого растворяющегося вещества, концентрация растворителя не снизилась более, чем на 5-10% от исходной. Во всех выше описанных случаях правая часть уравнения (16) или (16а) должна являться постоянной величиной, поэтому
. Определение порядка реакции можно упростить, если концентрацию активного реагента в ходе периодического опыта не изменять. Это достигается путем восполнения убыли реагента в ходе растворения (периодическое дозирование), или сделать это изменение пренебрежимо малым, проводя опыт с очень большим избытком активного реагента. Этого можно достичь предварительным расчетом, чтобы даже при полном растворении твердого растворяющегося вещества, концентрация растворителя не снизилась более, чем на 5-10% от исходной. Во всех выше описанных случаях правая часть уравнения (16) или (16а) должна являться постоянной величиной, поэтому 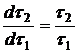 , и зависимость
, и зависимость ![]() является линейной.
является линейной.
Поэтому необходимость в дифференцировании отпадает, и расчетная формула для ![]() принимает вид:
принимает вид:
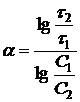 (17)
(17)
Смотрите также
Никелирование и хромирование
...
Расчет ректификационной колонны
...
Введение
Трудно переоценить значение крупномасштабного производства аренов для
химической промышленности и для всей экономики. Бензол и его производные
являются основным источником всех ароматических соедине ...


