Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Водородные соединенияОткрытая химия / Химические свойства элементов / Открытая химия / Химические свойства элементов / Водородные соединения Водородные соединения
p-Элементы с водородом образуют соединения с ковалентно-полярными связями.
Степень полярности связи легко оценить по разности электроотрицательностей элементов (ΔЭО). Так, для B, C, P, Si, Ge, As, Sn, Sb связь в соединениях с водородом практически ковалентная.
Из рассмотрения изменения в группах и периодах электроотрицательности соответствующих p-элементов и радиусов их атомов (ионов) можно сделать следующее обобщение: в пределах каждой подгруппы элементов обычно уменьшается прочность водородных соединений; в пределах каждого периода возрастает их кислотность. Валентный угол в группе с ростом Z уменьшается (табл. 8.6). Это объясняется ослаблением способности валентных орбиталей элементов к sp3-гибридизации из-за увеличения разности энергии s- и p-подуровней.
| ||||||||||||||||||||
|
Таблица 8.6 Изменение валентного угла в соединениях ЭH3 и H2Э |
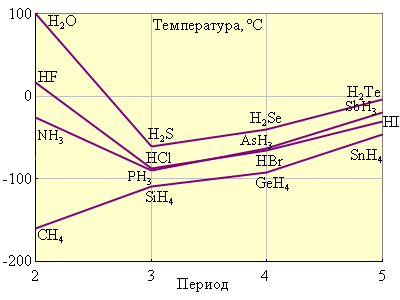
Кроме общих закономерностей водородные соединения p-элементов обнаруживают аномалию в проявлении некоторых свойств, в частности, в температурах кипения (рис. 8.6) и плавления.
Обычно с увеличением молекулярной массы температуры кипения и плавления соединений увеличиваются. Ожидаемый ход кривой наблюдается только для водородных соединений IVА группы (CH4, SiH4, CeH4, SnH4), в трех других рассмотренных группах обнаруживаются аномально высокие точки кипения для NH3, H2O, NF. Это объясняется образованием из молекул этих веществ ассоциатов –H–F .H–F . за счет водородной связи *). Интересно отметить, что наиболее прочной является водородная связь между молекулами HF, т. к. фтор – наиболее электроотрицательный элемент, однако, как видно из рис. 8.6, самая высокая температура кипения у воды. Объясняется это тем, что каждая молекула воды может образовать две водородные связи, тогда как молекула фтористого водорода – только одну.
 |
|
Рисунок 8.6 Температуры кипения гидридов некоторых p-элементов |
*) Напомним, что Н-связь возникает по донорно-акцепторному механизму между молекулами Н–Э, где Э – сильно электроотрицательный элемент, имеющий неподеленные электронные пары (O, N, F, S, Cl). Энергия Н-связи H .F равна 34 кДж, Н .О – 25,5 кДж и H .N – 8 кДж.
Среди водородных соединений p-элементов особое место принадлежит соединениям бора (бороводородам, боранам) B2H6, B4H10, B6H10, B5H11 и др. Они интересны тем, что относятся к электронодефицитным соединениям – число электронов в этих соединениях меньше, чем требуется для образования двухэлектронных двухцентровых связей. В диборане B2H6 двенадцать валентных электронов участвуют в восьми связях. В двух концевых группах BH2, которые лежат в одной плоскости, атомы бора и водорода связаны двухцентровыми двухэлектронными связями. Два же центральных атома водорода расположены симметрично над этой плоскостью и под нею и объединены с атомами бора трехцентровыми мостиковыми связями (рис. 8.7а), хорошо описываемыми с позиций ММО. На рис. 8.7б изображена схема трехцентровых МО диборана (фрагмент В–Н–В). Здесь две атомные sp3-гибридные орбитали бора (по одной от каждого атома) с одним электроном перекрываются с 1s-орбиталью атома водорода, которая дает еще один электрон, образуя связывающую, несвязывающую и разрыхляющую электронные орбитали. Пара электронов занимает связывающую орбиталь, что обеспечивает устойчивость этих мостиковых связей в молекуле B2H6.
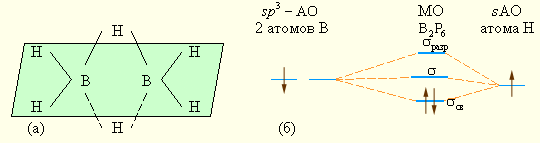 |
|
Рисунок 8.7 Строение (а) и схема (б) трехцентровых МО диборана |
Смотрите также
Моделирование парожидкостного равновесия
Выбор модели, адекватно описывающей
фазовое равновесие системы, является важным и необходимым шагом при решении
массообменного процесса. На сегодняшний день разработано достаточно большое
число мет ...
Композиционные материалы на основе полибутилентерефталата и его сополимеров
...
Обозначение констант равновесия межлигандного обмена хелатных комплексов экстрационно-фотометрическим методом
Хелаты настолько широко
вошли в современную химию, что сейчас трудно представить аналитическую лабораторию,
в которой эти соединения в том или ином виде не используются. Это объясняется преж ...


