Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Расчет и построение равновесной диаграммы потенциал – pH для
системы Cu – H2OДипломы, курсовые и прочее / Равновесные и поляризационные диаграммы потенциал-pH / Дипломы, курсовые и прочее / Равновесные и поляризационные диаграммы потенциал-pH / Расчет и построение равновесной диаграммы потенциал – pH для
системы Cu – H2O Расчет и построение равновесной диаграммы потенциал – pH для
системы Cu – H2OСтраница 2
![]() = 0,5·
= 0,5·![]() + 2·
+ 2·![]() -
- ![]() = - 220 569 Дж/моль
= - 220 569 Дж/моль
В общем виде электродный процесс можно записать как:
![]()
По основному закону термодинамики электрохимических систем:
![]() (2.2)
(2.2)
Свободная энергия Гиббса определяется по следующей формуле:
Δ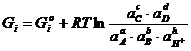 (2.3)
(2.3)
Подставляя (2.3) в (2.4), переходя от натуральных логарифмов к десятичным и с учетом того, что ![]() , получаем:
, получаем:
![]() (2.4)
(2.4)
Для линий чисто химических равновесий энергия Гиббса вычисляется по формуле:
![]() (2.5)
(2.5)
Подставляя уравнение (2.5) в (2.2) и проводя соответствующие преобразования, получаем:
![]() (2.6)
(2.6)
Исходя из приведенных выше формул, ведется расчет линий зависимости φ от pH для реакций (I) – (VII):
|
№ линии |
Электродная реакция |
Равновесный потенциал, В (н. в. э.) или рН раствора |
|
I |
|
|
|
II |
|
|
|
III |
|
|
|
IV |
|
|
|
V |
|
|
|
VI |
|
|
|
VII |
|
|
Для линий I, III, V и VI величину активности ионов Cu2+ можно варьировать. В данном случае берутся значения ![]() = 0, 10-2, 10-4 и 10-6. Тогда:
= 0, 10-2, 10-4 и 10-6. Тогда:
Для I:
φ1 = 0,337 В
φ2 = 0,278 В
φ3 = 0,219 В
φ4 = 0,160 В
Для III:
φ1 = 0,235 + 0,0591pH
φ2 = 0,117 + 0,0591pH
φ3 = - 0,001 + 0,0591pH
φ4 = - 0,120 + 0,0591pH
Для V:
pH1 = 3,58
pH2 = 4,58
pH3 = 5,58
pH4 = 6,58
Для VI:
φ1 = 1,566 – 0,1773pH
φ2 = 1,684 – 0,1773pH
φ3 = 1,802 – 0,1773pH
φ4 = 1,921 – 0,1773pH
Для данной системы построена равновесная диаграмма потенциал – pH:
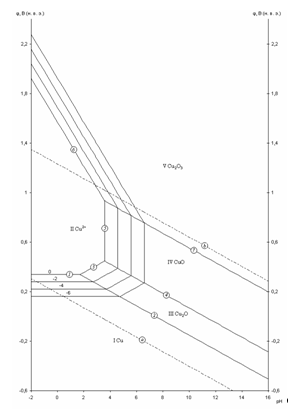
Рис. 2.1 - Равновесная диаграмма потенциал – pH для системы Cu – H2O
Смотрите также
Полимерные композиты на основе диальдегилцеллюлозы и полигуанилинметакрилата
Среди
полимеров, нашедших широкое применение в различных областях жизнедеятельности
человека, важное место занимает целлюлоза, как постоянно возобновляемый в
природе полимер, и ее производн ...
Разделение смеси бензол – циклогексан – этилбензол – н-пропилбензол экстрактивной ректификацией
Процесс
ректификации играет ведущую роль среди процессов разделения промышленных
смесей. Большая энергоемкость процесса делает поиск оптимальных схем разделения
актуальной задачей химическо ...


