Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Диаграмма равновесия воды.Дипломы, курсовые и прочее / Равновесные и поляризационные диаграммы потенциал-pH / Дипломы, курсовые и прочее / Равновесные и поляризационные диаграммы потенциал-pH / Диаграмма равновесия воды. Диаграмма равновесия воды.
На простейшей, но, как указано выше, очень важной в практическом отношении диаграмме равновесия потенциалы электродных реакций, протекающих на водородном [εР(Н+/H2)] и кислородном [εР(О2/ОН-)] электродах, приведены в и зависимости от рН раствора. Эта диаграмма, кроме того, дает сведения об электрохимической устойчивости воды.
Потенциал реакции водородного электрода при 25°С можно представить в виде
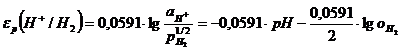 (1.3.11)
(1.3.11)
учитывая, что -lg![]() = pH. В этом уравнении
= pH. В этом уравнении ![]() =
=![]() /
/![]() , где
, где ![]() - давление газообразного водорода в системе, а
- давление газообразного водорода в системе, а ![]() - давление газа, выбранное в качестве стандартной величины (1,01325·105 Па).
- давление газа, выбранное в качестве стандартной величины (1,01325·105 Па).
На кислородном электроде реализуется следующая реакция:
O2 + 2H2O + 4ē = 4OH- (1.3.12)
Потенциал электродной реакции равен
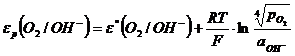 (1.3.13)
(1.3.13)
где ![]() (
(![]() – давление газообразного кислорода в системе); εР (O2/OH-) – стандартный потенциал электродной реакции (1.3.12), равный 0,401 В при 25°С.
– давление газообразного кислорода в системе); εР (O2/OH-) – стандартный потенциал электродной реакции (1.3.12), равный 0,401 В при 25°С.
С учетом ионного произведения воды ![]() получаем выражение
получаем выражение
![]() (1.3.14)
(1.3.14)
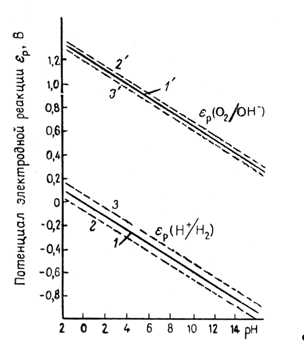
Рис. 1.3.1 - Диаграмма равновесия воды
На рис. 1.3.1. величины ![]() и
и ![]() , рассчитанные по уравнениям (1.3.11) и (1.3.14), приведены как функции pH. Сплошные прямые отвечают
, рассчитанные по уравнениям (1.3.11) и (1.3.14), приведены как функции pH. Сплошные прямые отвечают ![]() . При уменьшении pH на единицу потенциалы обоих электродов уменьшаются на 0,0591 В. Штриховые линии получают при уменьшении и увеличении давления водорода и кислорода на два порядка. В этом случае потенциал реакции водородного электрода (при постоянном pH) изменяется на 0,0591 В, а потенциал кислородного электрода – на 0,0295В. Следовательно, если построить график зависимости величин
. При уменьшении pH на единицу потенциалы обоих электродов уменьшаются на 0,0591 В. Штриховые линии получают при уменьшении и увеличении давления водорода и кислорода на два порядка. В этом случае потенциал реакции водородного электрода (при постоянном pH) изменяется на 0,0591 В, а потенциал кислородного электрода – на 0,0295В. Следовательно, если построить график зависимости величин ![]() и
и ![]() от pH, то получаются две параллельные прямые, причем их истинное расположение зависит от давления газа. В интервале между двумя прямыми вода устойчива, т.е. при обычных условиях на электродах, работающих при потенциалах в пределах указанного интервала, не происходит выделения водорода или кислорода (это «интервал устойчивости» воды). За пределами этого интервала (т.е. при электродных потенциалах более отрицательных, чем
от pH, то получаются две параллельные прямые, причем их истинное расположение зависит от давления газа. В интервале между двумя прямыми вода устойчива, т.е. при обычных условиях на электродах, работающих при потенциалах в пределах указанного интервала, не происходит выделения водорода или кислорода (это «интервал устойчивости» воды). За пределами этого интервала (т.е. при электродных потенциалах более отрицательных, чем ![]() , и более положительных, чем
, и более положительных, чем ![]() ) вода разлагается соответственно с выделением водорода и кислорода.
) вода разлагается соответственно с выделением водорода и кислорода.
Поэтому в водных растворах можно достаточно надежно изучать равновесие и электродную реакцию на простых электродах, если потенциал данной реакции находится в пределах интервала устойчивости воды, а электролит не содержит растворенных газов H2 и O2. Если потенциал электродной реакции находится за пределами интервала устойчивости воды, то нельзя достичь равновесия исследуемой реакции [4].
Смотрите также
Каталитический риформинг
Бензины являются
одним из основных видов горючего для двигателей современной техники.
Автомобильные и мотоциклетные, лодочные и авиационные поршневые двигатели потребляют
бензины. В настоящ ...
Выплавка стали
...
Синтез бензальанилина
Цель работы:
провести литературный обзор по аминам. Синтезировать бензальанилин.
Амины –
производные аммиака, в которых атомы водорода замещены углеводородными
группами. Атом азота в ам ...


