Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Химические методы дегазации водыДипломы, курсовые и прочее / Дегазация воды / Дипломы, курсовые и прочее / Дегазация воды / Химические методы дегазации воды Химические методы дегазации водыСтраница 2
На рис. 19.9 показана схема удаления кислорода ионообмен- ником, заряженным палладием, с использованием водорода в качестве катализатора. Остаточное содержание кислорода 20 . , 30 мкг/л при исходном 9,0 мг/л.
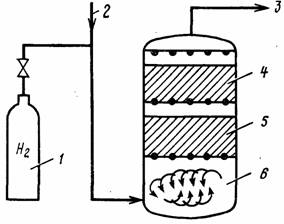
Рис. 19.9. Установка обескислороживания воды с помощью иоиообменника с палладием. 1 — баллон с водородом; 2, 3 — ввод исходной и отвод обескислороженной воды;4 — ионообменник заряженный палладием;5 — слой инертной смолы; 6 — камера смешения
Эффективное обескислороживание воды может быть достигнуто в электролизерах с растворимыми железными или алюминиевыми электродами. Обескислороживание происходит за счет катодной и анодной деполяризации, а также химического окисления железа или алюминия растворенным в воде кислородом. Для удаления из воды сероводорода химическими методами его окисляют кислородом воздуха или хлором, кроме того, может быть использовано взаимодействие сероводорода с гидрок- сидом железа(III). Для более полного удаления сероводорода кислородом воздуха при аэрации воду подкисляют серной или соляной кислотой до рН=5,5.
Дозу кислоты, мг/л, для снижения рН определяют по формуле
![]()
где Щ — щелочность исходной воды, мг-экв/л; е1 — эквивалентная масса кислоты; С — концентрация серной или соляной кислоты в техническом продукте, %.
Очищенную воду необходимо стабилизировать подщелачиванием для устранения коррозионных свойств.
Сероводород окисляют хлором до свободной серы или до серной кислоты (в зависимости от дозы хлора). Малые дозы хлора (2,1 мг на 1 мг свободного сероводорода) окисляют сероводород до коллоидной серы:
H2S + С12 = 2НС1 + S ,
которую затем необходимо удалять. В этом заключается недостаток метода. Большие дозы хлора (8,4 мг/мг) окисляют сероводород до серной кислоты:
H2S + 4С12 + 4Н20 = H2S04 + 8НС1.
Реакция протекает довольно медленно и имеет практическое значение лишь при окислении небольших количеств сероводорода. Ее используют для удаления остаточного сероводорода, например, после аэрирования.
Д. П. Козырев предложил метод удаления сероводорода гидроксидом железа(III) с последующей регенерацией образующегося сульфида железа(II). В основу этого способа положены реакции:
в щелочной среде
2Fe (ОН)3+3H2S = Fe2S3 + 6Н20,
в нейтральной среде
2Fe (ОН)2 + 3H2S = 2FeS + S + 6H2O.
Практика показала, что свободный сероводород удаляется этим методом довольно полно: вода теряет запах сероводорода, и коррозионные свойства. Обработанная вода после 2 3 ч отстаивания считается пригодной для технических нужд. Воду для питьевых и хозяйственно-бытовых нужд после предварительной обработки известью (около 60 мг/л в пересчете на СаО) необходимо отфильтровать.
Этот метод не новый, в нем оригинально лишь получение гидроксида железа(III) электрическим растворением металлического железа и чугуна и регенерация сульфида железа(II), которая происходит при наличии кислорода и воды по уравнениям:
2Fe2S3 + 6Н20 + 302 = 4Fe (ОН)3 + 6S.
4FeS + 6Н20+ 302 = 4Fe (ОН)3+ 4S .
Естественная регенерация протекает медленно. Для ускорения процесса прибегают к искусственной регенерации, которая достигается аэрированием или обработкой веществами, быстро переводящими сернистые соединения в гидроксиды (серная или соляная кислота). Для окисления сульфидных соединений применяют также перманганат калия:
Смотрите также
Диэлектрические композиты на основе модифицированного субмикронного титаната бария и цианового эфира ПВС
Полимерно-неорганические композиты находят широкое
применение в различных областях техники благодаря сочетанию свойств полимера и
функционального наполнителя, что позволяет получать материал ...
Иод
ИОД (лат. Iodium), I - химический элемент VII группы
периодической системы Менделеева,
относится к галогенам (в литературе встречается также символ J); атомный номер
53, атомная масса 126, ...
Ацетаты и ацетатные комплексы d-элементов 6 и 7 групп
Рассматриваемые
соединения – ацетаты и ацетатные комплексы элементов шестой и седьмой побочных
подгрупп. К комплексным соединениям относятся кластеры Cr+2, Mo+2,
Re+3, Tc+3. Данные элементы ...


