Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Диаграммы электрохимического равновесия системДипломы, курсовые и прочее / Термодинамика химической и электрохимической устойчивости сплавов системы Ni-Si / Дипломы, курсовые и прочее / Термодинамика химической и электрохимической устойчивости сплавов системы Ni-Si / Диаграммы электрохимического равновесия систем Диаграммы электрохимического равновесия системСтраница 1
Ni-H2O и Si-H2О. Общие положения. Применение диаграммы рН-потенциал. Электрохимическая устойчивость металлов и сплавов определяется их стойкостью к коррозии в водной среде. Лучшим способом представления термодинамической информации о химической и электрохимической устойчивости металлических систем в водных растворах являются диаграммы рН-потенциал. Впервые такие диаграммы в системе элемент-вода для чистых металлов при температуре 250С были построены Марселем Пурбе и использованы им для описания термодинамических коррозионных процессов.
На диаграммах Пурбе представлены различные химические и электрохимические равновесия, играющие роль в процессе коррозии металлов. Они характеризуют прежде всего состав водного раствора и устойчивость твердых фаз в зависимости от двух переменных: электродного потенциала и рН раствора для реально устанавливающихся равновесий. Электродные потенциалы φ выражены в вольтах по водородной шкале.
Диаграммы состоят из областей, разграниченных между собой кривыми равновесия. В случае жидких фаз положение границы зависит от активности не только ионов водорода, но и других ионов, участвующих в равновесии. В таких случаях, вместо одной кривой на рисунке нанесено семейство кривых, каждая из которых отвечает определенной активности соответствующих ионов (при этом для каждой кривой указано значение логарифма активности 0, - 2, - 4, - 6 и т.п.) [5].
На всех диаграммах рН-потенциал наносятся две основные линии диаграммы состояния воды (они наносятся пунктиром и обозначаются буквами а и b). Эти линии отвечают электрохимическим равновесиям воды продуктами ее восстановления - водородом (линия а) и окисления - кислородом (линия b). Область, заключенная между этими двумя линиями, является областью устойчивости воды. При потенциалах, лежащих вне этой области, т.е. выще линии b или ниже линии а, вода термодинамически неустойчива; выше линии b вода окисляется, а ниже линии а - восстанавливается.
Диаграммы Пурбе служат термодинамической основой при решении вопросов об устойчивости того или иного состояния системы и о возможности протекания в ней какой-либо реакции. В частности, ими можно пользоваться при рассмотрении вопросов об окислении металлов (как самопроизвольном, так и анодном) [10].
Методика расчетов диаграмм рН-потенциал
Для расчета и построения диаграмм рН-потенциал необходимо располагать сведениями об основных реакциях (окисления и восстановления, комплексообразования и осаждения), возможных в данной системе, об их количественных характеристиках (энергии Гиббса, произведение растворимости и т.д.) и передать графически в координатах рН-потенциал.
Линии на диаграмме рН-потенциал рассчитываются по равновесию, записанному в общей форме:
![]() ; (1.26)
; (1.26)
для которого можно записать уравнение равновесного потенциала:
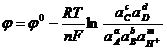 ; (1.27)
; (1.27)
где ![]() - равновесный потенциал системы;
- равновесный потенциал системы;
![]() - стандартный потенциал системы;
- стандартный потенциал системы;
![]() - универсальная газовая постоянная;
- универсальная газовая постоянная;
![]() - постоянная Фарадея;
- постоянная Фарадея;
![]() - температура, К;
- температура, К;
![]() - активность иона в растворе.
- активность иона в растворе.
Введя общепринятое обозначение ![]() , получим:
, получим:
![]() ; (1.28)
; (1.28)
Для того чтобы построить диаграмму рН-потенциал по уравнению (1.28), выбирают фиксированные значения ![]() так, чтобы последний член имел постоянную величину. Затем строят прямую линию с одинаковой
так, чтобы последний член имел постоянную величину. Затем строят прямую линию с одинаковой ![]() при рН=0 и наклоном
при рН=0 и наклоном ![]() . При 25 0С значение
. При 25 0С значение ![]() равно 0,0591 В, тогда наклон прямой равен
равно 0,0591 В, тогда наклон прямой равен ![]() .
.
Смотрите также
Проблемы и решения на уровне учения о химических процессах
Учение о
химических процессах - это область науки, в которой существует наиболее
глубокое взаимопроникновение физики, химии и биологии. На этом уровне развития
химических знаний химия становится на ...
Фтор
ФТОР (лат. Fluorum), F - химический элемент
VII группы периодической системы Менделеева, относится к галогенам, атомный номер 9, атомная масса 18,998403; при нормальных условиях (0 °С; 0,1 ...


