Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Теория кристаллического поляДипломы, курсовые и прочее / Синтез и свойства комплексов железа (II) и железа (III) / Дипломы, курсовые и прочее / Синтез и свойства комплексов железа (II) и железа (III) / Теория кристаллического поля Теория кристаллического поляСтраница 1
железо соединение лиганда кристаллическое поле
Для теоретического изучения комплексных соединений (КС) широко используется теория кристаллического поля (ТКП). Она была предложена Бетэ в 1929 г для кристаллов, а с 50-хх годов прошлого века стала широко использоваться в химии комплексных соединений [1].
Теория кристаллического поля исходит из того, что природа лигандов и их расположение вокруг центрального иона (симметрия комплекса) уменьшают вырождение d-орбиталей и изменяют их энергию. Рассмотрим это на примере комплексного иона октаэдрической симметрии [ML6]n+, в котором центральный атом имеет электронную конфигурацию d1. Ион M+ расположен в центре октаэдра, совпадающем с началом прямоугольной системы координат, а лиганды – в вершинах октаэдра.
Орбитали dx²–y² и dz² совпадают с координатными осями, а остальные три (dxy, dxz, dyz) проходят вдоль биссектрис соответствующих координатных углов. B отсутствие лигандов все пять орбиталей были энергетически равноценны. Но с появлением лигандов в вершинах октаэдра электроны, находящиеся на орбиталях dx²–y² и dz², испытывают сильное отталкивание от отрицательно заряженных лигандов или от отрицательного конца полярной молекулы. Другие три орбитали попадают в области с минимальными значениями отрицательного потенциала, поэтому вероятность нахождения электрона на орбиталях dxy, dxz, dyz будет больше. Это соответствует тому, что под действием лигандов прежде энергетически равноценные d-орбитали разделились на две группы: орбитали dx²–y² и dz²(dγ), энергетически невыгодные для электрона, и орбитали dxy, dxz, dyz(dε) с меньшей энергией. Схема расщепления d-орбиталей октаэдрическим (тетраэдрическим) окружением показана на рис. 1. Разность между dε и dγ-уровнями обозначается через Δокт (Δтетр) и называется параметром расщепления. В научной литературе орбитали обычно dγ и dε обозначают deg и dt2g, а параметр расщепления 10Dq [1].
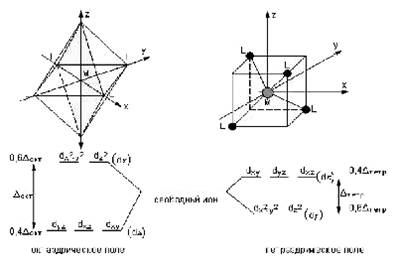
рис 1. Диаграмма расщепления d-орбиталей в поле лигандов.
Из рис. 1 следует, что заселение любой dε-орбитали одним электроном приводит к уменьшению на 0,4Δокт энергии октаэдрического комплекса, т. е. стабилизирует его по сравнению со сферически симметричным ионом, а заселение электроном любой из dγ-орбиталей этот комплекс дестабилизирует на 0,6Δокт. В тетраэдрическом поле порядок расщепления d-орбиталей будет обратным, а потому энергия стабилизации на один электрон будет 0,6Δтетр, а дестабилизации - 0,4 Δтетр. Величина понижения энергии координационного соединения в результате перераспределения d-электронов по dε- и dγ-орбиталям называется энергией стабилизации кристаллическим полем (ЭСКП). Эта энергия зависит от числа электронов на dε- и dγ-орбиталях и вычисляется по формулам [1]:
ЭСКП(окт) = (0,4n – 0,6m) Δокт
ЭСКП(тетр) = (0,6n – 0,4m) Δтетр
где n – число электронов на нижнем подуровне, m – число электронов на верхнем подуровне. Параметр расщепления в октаэдрическом поле больше, чем в тетраэдрическом, содержащем те же лиганды, и равен Δокт = 9/4 Δтетр
Смотрите также
Характеристика белков
Белки - высокомолекулярные азотистые органические
вещества, построенные из аминокислот и играющие
фундаментальную роль в структуре и жизнедеятельности организмов. Белки –
основная и не ...
Исследование кинетики реакции хлорирования бензола
...
Реакторный графит: разработка, производство и свойства
Конструкционные
углеродные материалы (КУМ) нашли широкое применение в атомных реакторах
различного назначения: исследовательских, транспортных, промышленных
уран-графитовых (ПУГР), высокоте ...


