Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электролитическая диссоциация воды. Водородный показательДипломы, курсовые и прочее / О растворах / Дипломы, курсовые и прочее / О растворах / Электролитическая диссоциация воды. Водородный показатель Электролитическая диссоциация воды. Водородный показатель
Вода является слабым электролитом, который диссоциирует по уравнению: ![]() .
.
Это явление называется самоионизацией или автопротолизом.
Константа диссоциации воды при 250 С составляет:
![]()
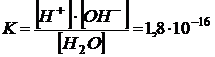
Так как константа диссоциации воды очень мала, можно считать концентрацию воды постоянной величиной:
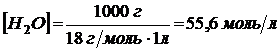
Тогда:
![]()
![]() (при 295 К)
(при 295 К)
Величина Kw называется ионным произведением воды.
Ионное произведение воды характеризует равновесие между ионами водорода и гидроксид-ионами в водных растворах и является постоянной при данной температуре величиной.
Кислотность или основность водного раствора может быть выражена концентрацией ионов водорода или гидроксид-ионов. Чаще всего для этой цели используют величину рН, которая связана с концентрацией ионов водорода следующим соотношением:
![]()
В нейтральной среде:
![]() ; рН = 7
; рН = 7
В кислой среде:
![]() ; рН < 7
; рН < 7
В щелочной среде:
![]() ; рН > 7
; рН > 7
Зная рН, легко рассчитать рОН, и наоборот, т.к.: рН + рОН = 14.
Расчёт рН и рОН растворов сильных и слабых электролитов.
Концентрацию ионов Н+ определяют по уравнению Оствальда: [H+]=![]() ; аналогично для гидроксила: [ОH–]=
; аналогично для гидроксила: [ОH–]=![]() ;
;
Смотрите также
Приготовление основных стандартных растворов металлов с
концентрацией
1.
Средства измерений, реактивы, оборудование
Весы
лабораторные аналитические любого типа 2-го класса точности
Колбы
мерные наливные : 2-1000-2 по ГОСТ 1770
Цилиндры
мерные: 1-50 по ГОСТ ...
Термодинамика химической устойчивости сплавов системы Mn-Si
Сплавы кремния с марганцем
относятся к группе аморфных металлических сплавов [1]. Следствием их аморфной
структуры являются необычные магнитные, механические, электрические,
физико-химическ ...
Технология приготовления косметических гелей
На
фоне довольно высоких темпов развития химической промышленности сегодня
ученому-исследователю очень трудно уследить за тенденциями развития
производства косметической продукции еще и по ...


