Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Особые случаи составления уравнений
окислительно-восстановительных реакцийДипломы, курсовые и прочее / Общая и неорганическая химия / Дипломы, курсовые и прочее / Общая и неорганическая химия / Особые случаи составления уравнений
окислительно-восстановительных реакций Особые случаи составления уравнений
окислительно-восстановительных реакцийСтраница 1
Рассмотренная методика составления окислительно-восстановительных реакций применима к большинству простых и сложных процессов. Но в некоторых специальных случаях необходимы дополнительные пояснения.
1. Если число электронов, отдаваемое восстановителем, и число электронов, присоединяемое окислителем, имеют общий наибольший делитель, то при нахождении коэффициентов оба числа делят на него. Например, в реакции
HCl7+O4 + 4S4+O2 + 4H2O = 4H2S6+O4 + HCl1-
основными коэффициентами для восстановителя и окислителя будут не 6 и 2, а 4 и 1.
Если число участвующих в реакции электронов нечетно, а в результате получается четное число атомов, то коэффициенты удваиваются. Например, в реакции
2Fe3+Cl3 + 2HJ1- = J20 + 2Fe2+Cl2 + 2HCl
основными коэффициентами будут не 1 и 1, а 2 и 2.
2. Окислитель или восстановитель иногда дополнительно расходуется на связывание получающихся продуктов (солеобразование).Например, в реакции
Cu + 2HNO3 + 6HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
на окисление на связывание на 3 атома восстановителя Сu0 требуется для окисления 2 молекулы окислителя HNO3; кроме того, на образование нитрата меди - трех молекул - требуется еще 6 молекул HNO3 для связывания трех атомов меди. Таким образом, общий расход азотной кислоты: 2 молекулы на окисление плюс 6 молекул на связывание (солеобразование), то есть всего 8 молекул HNO3. И окончательно уравнение примет вид:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
З. Если в реакции число элементов, изменяющих свою степень окисления, больше двух, то устанавливают общее число электронов, отдаваемых восстановителями, и общее число электронов, присоединяемых окислителями, а в остальном соблюдается общий порядок составления уравнения реакции. Например,
3As3+2S2-3 + 28HN5+O3 + 4H2O ® 6H3As5+O4 + 9H2S6+O4 + 28N2+O
![]()
![]() 2As3+ - 4e ® 2As5+ -28e 3
2As3+ - 4e ® 2As5+ -28e 3
![]() 3S2- - 24 ® 3S6+
3S2- - 24 ® 3S6+
N5+ + 3e ® N2+ +3e 28
4. Оба элемента – и окислитель, и восстановитель – находятся в одной и той же молекуле. Это реакция внутримолекулярного окисления-восстановления и реакции диспропорционирования. Для удобства подбора коэффициентов в этом случае иногда можно рассматривать процесс как бы идущим справа налево. Например,
3HN3+O2 ® HN5+O3 + 2 N2+O + H2O
![]() N3+ + e ® N2+ 2
N3+ + e ® N2+ 2
N3+ - 2e ® N5+ 1
Продукты окислительно-восстановительных реакций устанавливаются опытным путём
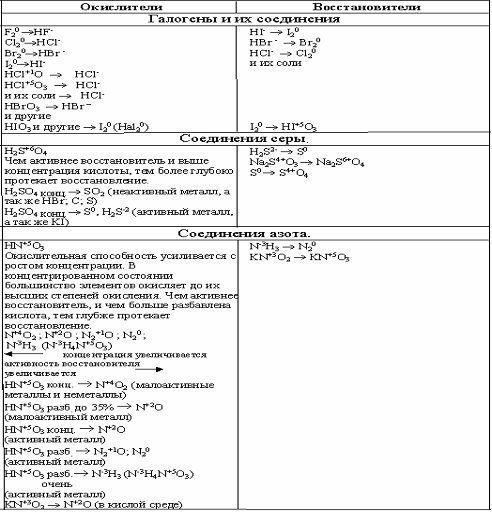
Элементы, имеющие высшую
степень окисления, могут быть только окислителями.
Элементы, имеющие низшую
степень окисления, могут быть только восстановителями.
Элементы, находящиеся в промежуточной
степени окисления, могут и окисляться, и
восстанавливаться, то есть проявляют окислительно-восстановительную двойственностьТипичные окислители
: металлы, соединения неметаллов в низшей степени окисленияТипичные восстановители
: галогены, О2, N2, вещества, содержащие элемент в высшей
СО.
Реакции окисления - восстановления могут протекать в различных средах: в кислой, нейтральной и щелочной. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления. Рассмотрим пример влияния среды на восстановление перманганат- иона MnO4


