Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Влияние рН на окислительно-восстановительные свойства и
направление ОВРДипломы, курсовые и прочее / Общая и неорганическая химия / Дипломы, курсовые и прочее / Общая и неорганическая химия / Влияние рН на окислительно-восстановительные свойства и
направление ОВР Влияние рН на окислительно-восстановительные свойства и
направление ОВРСтраница 2
Окислительно-восстановительные реакции (ОВР) (реакции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении - понижается.
Первоначально окислением называли только реакции веществ с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует.
В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого (окислителя), например:
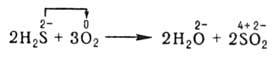
При этом окислитель восстанавливается, а восстановитель - окисляется. При протекании реакций в гальваническом элементе переход электронов осуществляется по проводнику, соединяющему электроды элемента, и изменение энергии Гиббса ДG в данной реакции может быть превращено в полезную работу. В отличие от реакций ионного обмена окислительно-восстановительные реакции (ОВР) в водных растворах протекают, как правило, не мгновенно.
При окислительно-восстановительных реакциях атомы в высшей степени окисления являются только окислителями, в низшей - только восстановителями; атомы в промежуточной степени окисления в зависимости от типа реакции и условий ее протекания могут быть окислителями или восстановителями. Многие окислительно-восстановительные реакции (ОВР) - каталитические По формальным признакам окислительно-восстановительные реакции (ОВР) разделяют на межмолекулярные (например, 2SO2 + O2 → SO3) и внутримолекулярные, например:
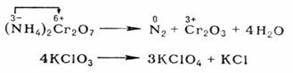
Последняя реакция представляет собой самоокисление-самовосстановление (см. Диспропорционирование).
окислительно-восстановительные реакции (ОВР) часто сопровождаются высоким энерговыделением, поэтому их используют для получения теплоты или электрической энергии. Наиболее энергичные окислительно-восстановительные реакции (ОВР) протекают при взаимодействии восстановителей с окислителями в отсутствие растворителя; в растворах такие реакции могут быть невозможны вследствие окислительно-восстановительного взаимодействия одного или обоих реагентов с растворителем. Так, в водном растворе нельзя непосредственно провести реакцию 2Na + F2 → 2NaF, поскольку натрий и фтор бурно взаимодействуют с водой. На окислительно-восстановительные свойства ионов сильно влияет комплексообразование, например: комплекс [Co2+(CN)6]4-, в отличие от гидратированного иона Со2+, является сильным восстановителем.
В случае окислительно-восстановительных реакций в органической химии использование обобщенной концепции окисления-восстановления и понятия о степени окисления часто малопродуктивно, особенно при незначительно полярности связей между атомами, участвующими в реакции. В органической химии окисление рассматривают обычно как процесс, при котором в результате перехода электронов от органического соединения к окислителю возрастает число (или кратность) кислородсодержащих связей (С — О, N — О, S — О и т.п.) либо уменьшается число водородсодержащих связей (С — Н, N —Н, S —Н и т.п.), например: RCHO → RCOOH; R2CHCHR2 → R2C=CR2. При восстановлении органических соединений в результате приобретения электронов происходят обратные процессы, например: R2CO → R2CH2; RSO2Cl → RSO2H.


