Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Фазовые равновесия в гетерогенных системах, фазовые
превращения и правило фаз. Диаграммы состоянияДипломы, курсовые и прочее / Общая и неорганическая химия / Дипломы, курсовые и прочее / Общая и неорганическая химия / Фазовые равновесия в гетерогенных системах, фазовые
превращения и правило фаз. Диаграммы состояния Фазовые равновесия в гетерогенных системах, фазовые
превращения и правило фаз. Диаграммы состоянияСтраница 2
В простейшем случае, если на основе компонентов А и В возможно образование жидкого раствора L и двух твердых растворов a и b, эвтектического и перитектического фазовых равновесий можно записать соответственно в виде реакций:
![]()
Поскольку в двойной системе состояние трехфазного равновесия является нонвариантным, эвтектические и перитектические реакции происходят при постоянной температуре, называемой соотв. эвтектической или перитектической, то есть на диаграмме состояния этим равновесиям отвечают горизонтали. В случае, если в определенной области температур и составов все три равновесно сосуществующие фазы являются твердыми (у одного из компонентов существуют полиморфные модификации с образованием твердого раствора g), возможны трехфазные равновесия, называют эвтектоидными и перитектоидными. Их можно представить соответствующими реакциями, аналогично эвтектическим и перитектическим фазовым равновесиям:
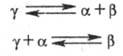
При наличии в некотором температурно-концентрационном интервале двух жидких фаз L1 и L2 и одной твердой (напр., а) возможны трехфазные равновесия, называют монотектическое и синтектическое:
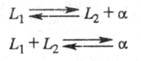
Некоторые виды трехфазных равновесий, например те, при которых образуется жидкость в результате взаимодействием двух кристаллических фаз при понижении температуры, теоретически возможны, но реально, по-видимому, не наблюдаются. При переходе к тройным и более сложным системам число видов многофазных фазовых равновесий возрастает еще больше (см. Тройная точка).Распределение компонентов между фазами системы при фазовом равновесии описывается законом распределения, устанавливающим, что отношение термодинамических активностей примеси в двух фазах при фазовое равновесие является постоянной величиной. В первом приближении активности компонентов можно заменить их концентрациями. Одним из условий выполнимости закона распределения вещества между фазами является одинаковость молекулярного состояния растворенного вещества в обеих фазах, то есть отсутствие ассоциации молекул. Замена активностей на концентрации допустима, если коэффициент активности компонента в обеих фазах не зависят от концентрации, то есть для идеальных растворов (это условие обычно выполняется для очень разбавленных растворов, в случае микроконцентраций). Отношение активностей компонентов называют коэффициентом распределения или коэффициентом относительной летучести и т. п. Частные случаи закона распределения - правила и законы, выражающие равновесное распределение вещества в двухфазных системах. Например, для расчета равновесия жидкости и пара пользуются законами Рауля и Генри, первым - для вещества, находящегося в избытке, вторым - для вещества, являющегося примесью. Распределение растворенного вещества между двумя несмешивающимися жидкостями при постоянной температуре характеризуется тем, что отношение его концентраций в этих двух фазах сохраняется постоянным (закон Бертло - Нернста). Распределение примеси между жидкой и твердой кристаллической фазой описывается распределениями Хлопина (равновесия) и Дёрнера-Хоскинса.Законы распределения являются основой разнообразных гетерогенных методов очистки (разделения), хотя само фазовое равновесие в процессе проведения этих методов очистки достигается далеко не всегда, а иногда сама возможность очистки обусловлена отсутствием фазового равновесия (см. Кристаллизационные методы разделения смесей, Ректификация, Экстракция жидкостная).
Смотрите также
Синтез 4-бром-4’-гидроксибифенила
Настоящая работа посвящена синтезу 4-бром-4’-гидроксибифенила. Это
соединение является важным реагентом для синтеза ферроценсодержащих жидких
кристаллов. Введение в молекулу ферроцена бифени ...
Концептуальные уровни в познании веществ и химические системы
В данной работе рассматривается тема
"Концептуальные уровни в познании веществ и химические системы".
Химию обычно рассматривали как науку о составе и качественном превращении
раз ...


