Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Строение и физико-химические свойства аскорбиновой кислотыДипломы, курсовые и прочее / Технология производства аскорбиновой кислоты (витамина С) / Дипломы, курсовые и прочее / Технология производства аскорбиновой кислоты (витамина С) / Строение и физико-химические свойства аскорбиновой кислоты Строение и физико-химические свойства аскорбиновой кислотыСтраница 1
Строение аскорбиновой кислоты следующее:

Аскорбиновая кислота является производным моносахарида L-ряда. Это строение подтверждено синтезами, в которых исходными веществами являются L-сорбоза (наиболее доступна) или L-гулоза, превращающиеся в 2-кето-Ь-гуло-новую кислоту—ключевой полупродукт в синтезе аскорбиновой кислоты:
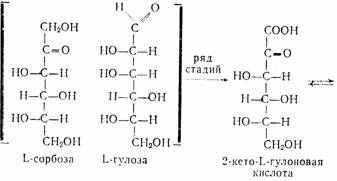 | |||
 | |||
Аскорбиновая кислота имеет два асимметрических атома углерода в положениях 4 и 5 и образует четыре оптических изомера и два рацемата:
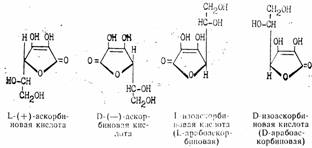
Биологически активной является L-(+)-форма. Д-(—)-форма является антивитамином и не существует в природе. Принятое строение аскорбиновой кислоты подтверждается рентгеноструктурным анализом. Молекулярная модель, установленная этим методом, показывает, что все атомы углерода и кислорода цикла лежат в одной плоскости, кроме С4, лежащего вне ее.
Аскорбиновая кислота представляет собой белое кристаллическое вещество с Тпл 192°, очень чувствительна к нагреванию, хорошо растворима в воде, плохо в спиртах (за исключением метанола), практически нерастворима в неполярных растворителях. Она очень чувствительна к тяжелым металлам, медь и железо разрушающе, действуют на аскорбиновую кислоту. Аскорбиновая кислота легко отщепляет протон гидроксила в положении Сз кольца и по силе не уступает карбоновым кислотам:
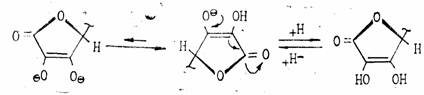
Аскорбиновая кислота является двухосновной, однако, ее считают практически одноосновной, поскольку pKI=4 12 а рКII =11,57.
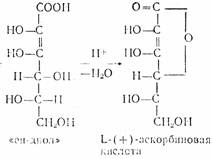
Кислотность обусловлена фенольной НО-группой. Аскорбиновая кислота легко образует соли — наиболее известна ее натриевая соль (аскорбинат натрия). Аскорбиновая кислота очень легко окисляется и обладает сильной восстановительной способностью. Процесс окисления аскорбиновой кислоты протекает сложно, начальной стадией его является образование т. н. дегидроаскорбиновой кислоты под влиянием кислорода воздуха или других окислителей. Этот процесс является обратимым:
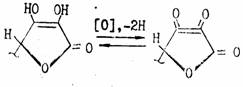
При рН<7 в процессе окислительного и гидролитического расщепления дегидроаскорбиновая кислота, например, превращается в 2,3-дикето-L-гулоновую кислоту. Последняя под влиянием повышенной температуры декарбоксилируется и превращается в L-ксилозон-2. Ксилозон восстанавливается аскорбиновой кислотой в L-ксилозу, которая циклизуется в фурфурол путем дегидратации:
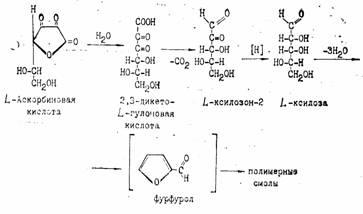
Известно, что фурфурол легко вступает в реакции присоединения, образуя полимеры, а также легко окисляется с раскрытием цикла и образованием янтарной и других органических кислот и смолистых веществ.
Указанные процессы протекают даже в присутствии кислорода воздуха, образуя цикл каталитического разложения аскорбиновой кислоты. Поэтому желательно исключить воздействие кислорода на растворы аскорбиновой кислоты и ее препараты в производстве и при хранении.
Естественно, что в присутствии более сильных окислителей и, особенно, ионов тяжелых металлов (медь, магний, железо) аскорбиновая кислота окисляется с деструкцией цикла и образованием в итоге различных органических кислот (L-трео-новая, глицериновая, щавелевая и др.). Все процессы окисления идут легче в щелочной среде.
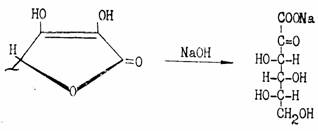
При нагревании со щелочами аскорбиновая кислота легко гидролизуется, превращаясь в соль 2-кето-L-гулоновой кислоты:
Из других свойств аскорбиновой кислоты следует отметить ее способность к образованию простых и сложных эфиров. Наиболее известен пальмитат аскорбиновой кислоты, который используют для витаминизации пищевых продуктов:
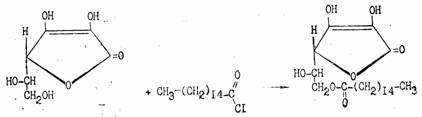
Методы синтеза аскорбиновой кислоты, выбор рационального способа производства
Аскорбиновая кислота может быть получена из моносахаридов D- или L-ряда.
Известно несколько методов ее синтеза.
1. Бензоиновый метод. В основе лежит конденсация— треозы и этилглиокислота в присутствии KCN. Метод неперспективен из-за дефицитности сырья, низкого выхода.
2. Циангидриновый метод. Аскорбиновую кислоту получают, исходя из L-ликсозы или L-ксилозы. Практического применения не имеет из-за отсутствия сырья, синтез которого из D-глюкозы очень сложен.
Смотрите также
Д. И. Менделеев
Свою мини творческую работу я хотел
бы начать с причин, которые подтолкнули меня к её написанию.
Во-первых, до написания этой работы я
знал о Дмитрии Ивановиче только то, что он был Велик ...
Применение ЭВМ в технологии лекарственных препаратов
...
Процесс катализа
...


