Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Термодинамический анализ основной реакцииДипломы, курсовые и прочее / Синтез циклогексанона / Дипломы, курсовые и прочее / Синтез циклогексанона / Термодинамический анализ основной реакции Термодинамический анализ основной реакцииСтраница 5
4.7. На основании полученных данных построим графики:
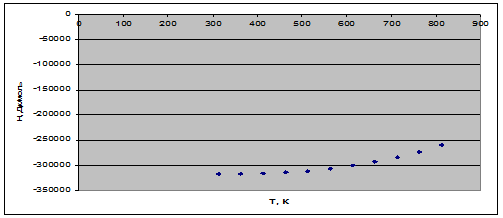
Рис. 1. Зависимость теплового эффекта реакции от температуры.
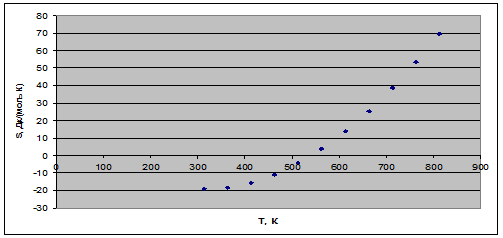
Рис. 2. Зависимость энтропии реакции от температуры.
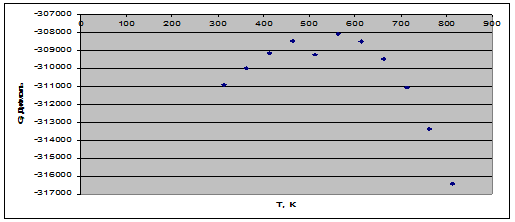
Рис. 3. Зависимость энергии Гиббса от температуры.
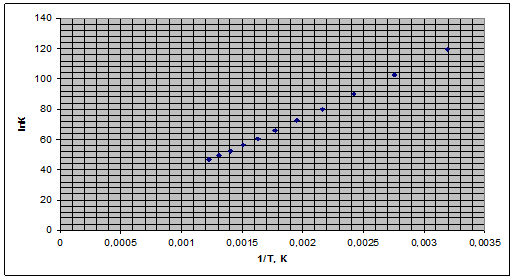
Рис. 4. Зависимость логарифма константы равновесия от обратной температуры.
![]()
![]()
![]()
![]()
613 – -299995,0714
х– -299304
![]() К
К
Выводы:
Рассчитав термодинамические величины, получили:
1) Реакция является экзотермической на всем температурном интервале, т.к. ![]() .
.
2) Для проведения процесса оптимальной считается температура 3390С (612 К).
3) С увеличением температуры изменение энтропии в ходе процесса увеличивается.
4) На всем температурном интервале ![]() , следовательно, реакция идет самопроизвольно.
, следовательно, реакция идет самопроизвольно.
5) Кр>>1, следовательно, реакция смещена в прямом направлении (в сторону образования продуктов), т.к. Кр больше 1020 реакция является необратимой.
Смотрите также
Органические соединения.
Органическими
называются соединения углерода. Простейшими по составу органическими
соединениями являются углеводороды, соединения, в состав которых входят углерод
и водород.
В молекулах
органич ...
Определение содержания германия в твердом электролите GeSe-GeJ2
...


