Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Влияние различных катализаторов на скорость разложения
пероксида водородаДипломы, курсовые и прочее / Влияние добавок на устойчивость пероксида водорода в водных растворах / Дипломы, курсовые и прочее / Влияние добавок на устойчивость пероксида водорода в водных растворах / Влияние различных катализаторов на скорость разложения
пероксида водорода Влияние различных катализаторов на скорость разложения
пероксида водородаСтраница 1
Уравнение реакции разложения:
![]()
![]() 2Н2О2 2Н2О + О2
2Н2О2 2Н2О + О2
Исследовалось влияние на скорость разложения Н2О2 следующих катализаторов: оксида марганца (IV) MnO2; оксида железа (III) Fe2O3; активированного угля С; перманганата калия KMnO4; хлорида железа (III) FeCl3; дихромата калия K2Cr2O7. [6]
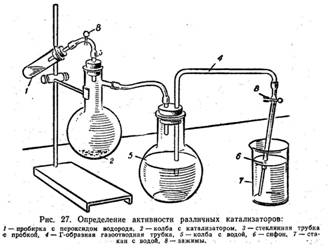
Рис. 1. Прибор для определения активности различных катализаторов
Опыты проводились в следующей последовательности:
1. Проверялась герметичность прибора (см. рисунок и фотографию выше), для чего закрываются пробки и открываются зажимы 8: вода не должна вытекать в стакан.
2. В пробирку 1 наливаем 5 смі пероксида водорода (6%-ного) и перекрываем резиновую трубку зажимом 8.
3. В колбу 2 вносим катализатор и вставляем в неё трубку 3, соединенную с пробиркой1.
4. Выравниваем давление внутри прибора с атмосферным давлением. С этой целью открываем зажим 8 сифона 6 и поднимаем стакан 7 с водой так, чтобы вода в нём и в колбе находилась на одинаковом уровне, и затем снова закрываем зажим.
5. Воду выливаем из стакана и наливаем в него точный её объем – 100смі, предварительно отмерив его мензуркой.
6. Опускаем кончик сифона 6 в стакан 7 с водой.
7. Открываем оба зажима 8 на приборе и быстро вливаем раствор пероксида водорода в колбу 2 с катализатором.
8. Через 3минуты вновь приводим давление внутри прибора к атмосферному давлению.
9. Закрываем зажимы сифона 6 и измеряем объем воды, вытесненной в стакан кислородом.
10. Из измеренного объема воды вычитаем 100смі, т.е. объем воды, ранее добавленной в стакан.
Результаты опытов отражены в таблице 1:
Таблица 1.
|
№ п./п. |
Катализатор |
Объем выделившегося кислорода, смі |
|
1 |
Оксид железа (III) Fe2O3 |
9 |
|
2 |
Активированный уголь С |
5 |
|
3 |
Перманганат калия KMnO4 |
3 |
|
4 |
Хлорид железа (III) FeCl3 |
10 |
|
5 |
Дихромат калия K2Cr2O7 |
8 |
|
6 |
Оксид марганца (IV) MnO2 |
7 |
В случае с перманганатом калия наблюдалось образование оксида марганца (IV), что указывает на протекание окислительно-восстановительной реакции, которую можно отразить следующим уравнением:
3H2O2 + 2KMnO4 2MnO2 + 3O2 + 2KOH + 2H2O
Поэтому говорить о KMnO4 как катализаторе не приходится. С учетом опытных данных располагаем испытанные катализаторы в порядке возрастания их каталитической активности:
Смотрите также
Методы получения наночастиц
Изучение
наноструктур интенсивно началось примерно двадцать лет назад, и уже занимает
определенное место в сфере применения. Хотя слово нанотехнология является
относительно новым, устройств ...
Композиционные материалы на основе полибутилентерефталата и его сополимеров
...
Магнийорганические соединения
Магнийорганические
соединения относятся к числу одних из самых известных металлоорганических соединений.
Они широко применяются в органическом синтезе, хотя в последнее время их
потеснили л ...


