Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Растворы титана.Дипломы, курсовые и прочее / Свойства титана и его соединений / Дипломы, курсовые и прочее / Свойства титана и его соединений / Растворы титана. Растворы титана.
В водных растворах Ti находится преимущественно в 4-валентном состоянии, но в определенных условиях существуют комплексы, в которых валентность титана равна трем. Малый ионный радиус позволяет ему приобретать заметную долю электронной плотности кислородного донора с образованием прочной ковалентной связи. Значения электроотрицательности для TiOH и TiO – 2,43 и 2,56 соответственно. Сродство ионов Ti+4 настолько велико, что комплексы практически всегда содержат кислород и образуют в растворах титана(IV) цепи с гидроксильными и кислородными мостиками.
Химия титана даже в разбавленных растворах оказывается связанной с процессами полимеризации.
В растворах титан может находиться в форме простых и комплексных ионов, а также в коллоидно-дисперсном состоянии. Превалирование той или иной формы зависит от условий получения и хранения раствора, его концентрации, содержания примесей и других факторов. Способность Ti вступать в типичные ионные реакции, например в окислительно-восстановительные, свидетельствует о том, что в растворах сернокислые соли диссоциирует на катионы и анионы. Так, превращение сульфата в хлорид при добавлении BaCl2:
Ti4++2SO42-+2Ba2++4Cl-=2BaSO4+Ti4++4Cl-
Происходит полно и ион Ti4+ не изменяется. Кристаллизация солей с четко выраженными стехиометрическими отношениями также является доказательством их ионной природы.
В водных сернокислых растворах существование ионов Ti4+ невозможно, так как Ti существует в виде гидратных комплексов Ti(H2O)64+, подвергающихся гидролизу с депротонизацией. С позиций представлений о льдоподобной структуре воды выполненные расчеты по данным кажущихся мольных объемов позволяют предполагать нахождение Ti(H2O)64+ как в каркасе структуры воды, так и в ее пустотах.
Прямых доказательств существования ионов титанила TiO2+ в растворе нет. Однако наличие TiO-группы в ряде соединений не вызывает сомнения. Термохимическим методом показано, что ион титанила обладает в растворе ярко выраженной положительной гидратацией. Гидратные числа, рассчитанные для Ti-форм при мольных соотношениях SO3 : Ti, равных 2 и 1, составляют 9и 5 соответственно, что близко к минимальным величинам для ионов U4+, Na+ и К+, найденным по данным числе переноса электролитов. С ростом концентрации титана гидратные числа уменьшаются и к моменту кристаллизации сульфатов становятся близкими к числу молекул Н2О на атом Ti, прочно связанных в твердой фазе.[6,c.66]
Гидролиз титансодержащих ионов или нейтральных молекул в сернокислых растворах – сложный физико-химический процесс. В нем различают несколько стадий: взаимодействие сульфатов титана с водой с их переходом в основные сульфаты, образование и рост мицелл гидроокиси, коагуляция мицелл с выпадением осадка. Процесс гидролиза сульфатов титана может быть представлен последовательными реакциями:
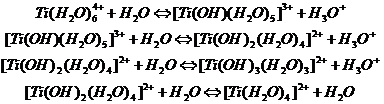
Смотрите также
Умягчение воды катионированием
...
Осмос, осмотическое давление и его биологическая роль
...
Усовершенствование технологии установки висбрекинга
Нефть и газ– это основные источники
энергии в современном мире. На топливах, полученных из них, работают двигатели
сухопутного, воздушного и водного транспорта, тепловые электростанции. В
н ...


