Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Физические и химические свойстваДипломы, курсовые и прочее / Свойства титана и его соединений / Дипломы, курсовые и прочее / Свойства титана и его соединений / Физические и химические свойства Физические и химические свойства
Титан – металл, элемент IV группы периодической системы Д.И. Менделеева. Порядковый номер 22. Атомная масса 47,88. Изотопы: 48 (основной), 46, 47, 49, 50. Плотность 4,5 г/см3. Существует в двух полиморфных модификациях: ά-Ti – при температурах ниже 882˚С, β-Ti - выше 882˚C. При переходе ά→β изменение объема составляет +5,5%, тепловой коэффициент перехода 0,38 ккал/г-атом. Температура плавления титана 1665+5˚С. Температура кипения 3572˚С. Давление паров при 1200-2000 К:
![]()
Прочность на разрыв чистого (иодидного) титана составляет примерно 20 кГ/мм2, товарного титана 30-40 кГ/мм2, прочность конструкционных сплавов на основе титана равна обычно 100-120 кГ/мм2, в отдельных же случаях достигает 140 кГ/мм2 и выше.
Все элементы периодической системы по отношению к титану по их химическому воздействию можно разделить на четыре группы:
1. Элементы, не взаимодействующие с титаном: Li, Na, K, Rb, Cs, Fr, Mg. Ca, Sr, Ba, Ra и инертные газы.
2. Элементы, образующие с титаном химические соединения с ковалентной связью, не имеющие или имеющие малую растворимость в титане: H, F, Cl, Br, I, At, O, S, Se, Te, Po.
3. Элементы образующие с титаном соединения с металлическим характером связи (металлические соединения) и ограниченные твердые растворы: Cu, Ag, Zn, Cd, Hg, Be, Ga, In, Tl, B, Al, Th, C, Si, Ge, Sn, Pb, N, P, As, Sb, Bi, Mn, Te, Re, Fe, Co, Ni, Ru, Rh, Pd, Os, Ir.
4. Элементы, образующие с титаном β-модификации непрерывных твердых растворов: Zr, Hf, V, Nb, Ta, Cr, Mo, Sc, W.
Таким образом, титан так или иначе взаимодействует с с большинством элементов. Это, с одной стороны, создает значительные трудности при получении чистого титана и его сплавов, а , с другой стороны, дает возможность получать большое количество разнообразных по составу и свойствам сплавов.[7,c.5]
Титан – довольно активный металл; стандартный электродный потенциал системы Ti/Ti2+ равен -1,63 В. Однако благодаря образованию на поверхности металла плотной защитной пленки титан обладает исключительно высокой стойкостью против коррозии, превышающей стойкость нержавеющей стали. Он не окисляется на воздухе, в морской воде и не изменяется в ряде агрессивных химических сред, в частности в разбавленной и концентрированной азотной кислоте и даже царской водке.[1,c.649]
Титан при низкой температуре более устойчив к действию кислорода, чем железо, однако при нагревании на воздухе он сгорает до TiO2. С хлором титан реагирует примерно при 300˚C.[2,c.635]
В отличие от циркония и гафния титан растворяется при нагревании в соляной кислоте, образуя в восстановительной атмосфере аквакомплексы Ti(III):
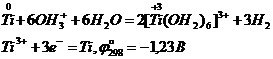
Смотрите также
Характеристика свойств нобелия
...
Ольдгамит
Кальция сульфид,
сернистый кальций, CaS - бесцветные кристаллы, плотность 2,58 г/см3,
температура плавления 2000 °С. ...
Пептиды и первичная структура белка
Пептиды и белки
представляют собой высокомолекулярные органические соединения, построенные из
остатков α-аминокислот, соединенных между собой пептидными связями.
Ни один из
известны ...


