Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электроды второго родаОткрытая химия / Химические источники тока / Открытая химия / Химические источники тока / Электроды второго рода Электроды второго родаСтраница 1
Электроды второго рода представляют собой металлические электроды, покрытые слоем труднорастворимой соли того же металла. При погружении в раствор соли одноименного аниона его потенциал будет определяться активностью иона в растворе.
а) Хлорсеребряный электрод (ХСЭ) Ag, AgCl|Cl– представляет собой серебряный проводник, покрытый твердым AgCl, который погружен в насыщенный раствор KCl.
Серебро электрохимически взаимодействует со своим ионом:
|
Ag+ + e– = Ag. |
Уравнение Нернста для этого процесса:
|
(7.2) |
Однако в присутствии труднорастворимого AgCl активность ионов серебра очень мала и ее трудно определить. Но активность ионов Ag+ связана с легко задаваемой в данной системе активностью ионов Cl– произведением растворимости хлорида серебра ПРAgCl:
| |
откуда
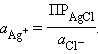 |
Подставляя это выражение в (7.2)
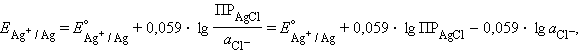 |
и обозначив
| |
получим уравнение Нернста для хлорсеребряного электрода:
|
Потенциалопределяющими являются ионы хлора, а электродный процесс может быть представлен уравнением
| |
б) Каломельный электрод (КЭ) Hg, Hg2Cl2|Cl– – это ртуть, находящаяся в контакте с пастой из смеси ртути и каломели Hg2Cl2, которая, в свою очередь, соприкасается с насыщенным раствором KCl.
Принцип действия каломельного электрода тот же, что и хлорсеребряного.
Электродная реакция сводится к восстановлению каломели до металлической ртути:
| |
Смотрите также
Выводы
Методом линейной
циклической вольтамперометрии исследовано совместное восстановление ионов
гадолиния и алюминия в хлоридных и хлоридно-фторидных расплавах на серебряном и
платиновом электродах.
...
Синтез 9-ортогидроксиаминоакридина
Одним из наиболее
перспективных и важных направлений в области медицинской химии является поиск
новых иммуностимуляторов, веществ обладающих противовирусной активностью. К
числу веществ, об ...
Свойства титана и его соединений
Титан находится в побочной
подгруппе четвертой группы, следовательно относится к переходным элементам.
Переходные элементы обладают определенными схожими свойствами.
Общая характеристика
...


