Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электрохимическое перенапряжениеДипломы, курсовые и прочее / Увеличение степени защиты стали от коррозии в нейтральных и кислых средах / Дипломы, курсовые и прочее / Увеличение степени защиты стали от коррозии в нейтральных и кислых средах / Электрохимическое перенапряжение Электрохимическое перенапряжение
При рассмотрении теоретических сведений о концентрационной поляризации было допущено, что концентрация частиц, участвующих в электродной реакции, мала по сравнению с общей концентрацией раствора, и скорость электродного процесса определяется только доставкой разряжающихся частиц к поверхности электрода. Однако в достаточно концентрированных растворах в условиях перемешивания скорость доставки разряжающихся частиц к электроду настолько велика, что их концентрация практически не отличается от концентрации в глубине раствора. В данном случае поляризация электрода определяется замедленностью какой-либо из стадий электродной реакции (ионизация или разряд) и носит, название электрохимической поляризации.
Перенапряжение (поляризация) перехода (разряд или ионизация) возникает, как было отмечено выше, когда наиболее медленной стадией электродного процесса является собственно электрохимическая реакция.
Скорость катодной и анодной реакций
![]()
в электрохимической системе выражается соответственно уравнениями
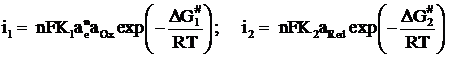 (1.15)
(1.15)
где ![]() – изменение энергии активации Гиббса, составляющее некоторую долю α от величины изменения энергии Гиббса реакции
– изменение энергии активации Гиббса, составляющее некоторую долю α от величины изменения энергии Гиббса реакции ![]() ; α - коэффициент переноса, показывающий, какую часть от разности энергии иона в кристаллической решетке металла и электролита раствора составляет энергия активации его электрохимической реакции.
; α - коэффициент переноса, показывающий, какую часть от разности энергии иона в кристаллической решетке металла и электролита раствора составляет энергия активации его электрохимической реакции.
При малых перенапряжениях уравнение поляризационной кривой оценивается уравнением
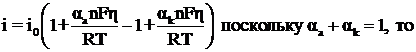
![]()
При высоких значениях перенапряжения, когда![]() , перенапряжению при катодной реакции приписывают отрицательный знак, при анодной реакции – положительный. Отсюда величины катодного и анодного токов выражаются уравнениями:
, перенапряжению при катодной реакции приписывают отрицательный знак, при анодной реакции – положительный. Отсюда величины катодного и анодного токов выражаются уравнениями:
![]() (1.16)
(1.16)
![]() (1.17)
(1.17)
![]()
Последнее уравнение было получено Тафелем (1905) при экспериментальном определении перенапряжения водорода.
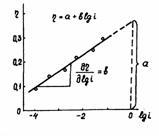
Рисунок 1.5 –
Диаграмма для определения констант а, b в уравнении Тафеля.
Используя катодные и анодные поляризационные кривые, осуществляя экстраполяцию их линейных участков, подчиняющихся уравнению Тафеля, на η = 0, возможно найти плотности тока обмена, а также α – коэффициент переноса заряда по углам наклона прямолинейных участков в координатах η – lgi [31].
Смотрите также
Тиофен
Тиофен содержится в каменноугольной
смоле и является спутником коксохимического бензола (присутствует в количестве
0,5%). По ряду физических и химических свойств тиофен очень близок к бензолу:
темп ...
Прочносвязанные полисахариды в клеточных стенках ксиланового типа
Клеточная
стенка – один их немногих клеточных компартментов, наличие которого
принципиально отличает растительную клетку от животной. Казалось бы, она должна
пользоваться особым вниманием б ...
Физико-химические свойства серебра
Серебро – известно человечеству с
древнейших времен. В природе оно встречается как в самородном состояние, так и
в виде соединений. Самой распространенной серебряной рудой является серебря ...


